Содержание
- Правилахранения лекарственных средств для ветеринарного применения
- II. Общие требования к помещениям для хранения лекарственных средств и организации хранения лекарственных средств
- III. Особенности организации хранения лекарственных средств в складских помещениях
- IV. Требования к помещениям для хранения пожаровзрывоопасных и пожароопасных лекарственных средств и организации их хранения
- V. Особенности хранения отдельных групп лекарственных средств в зависимости от физических и физико-химических свойств, воздействия на них различных факторов внешней среды
- Хранение лекарственных средств, требующих защиты от воздействия влаги
- Хранение лекарственных средств, требующих защиты от улетучивания и высыхания
- Хранение лекарственных средств, требующих защиты от воздействия повышенной температуры
- Хранение лекарственных средств, требующих защиты от воздействия пониженной температуры
- Хранение лекарственных средств, требующих защиты от воздействия газов, содержащихся в окружающей среде
- Хранение антисептических лекарственных средств
- Хранение лекарственного растительного сырья
- Хранение пожароопасных лекарственных средств
- Хранение пожаровзрывоопасных лекарственных средств
- Хранение наркотических и психотропных лекарственных средств
- Хранение сильнодействующих и ядовитых лекарственных средств
- Изменения,которые вносятся в акты Правительства Российской Федерации по вопросу установления регулируемых цен (тарифов) в электроэнергетике
- Информацияоб осуществлении технологического присоединения по договорам, заключенным за текущий год
- Информацияо поданных заявках на технологическое присоединение за текущий год
- Правилаформирования единого государственного реестра заключений экспертизы проектной документации объектов капитального строительства
- II. Структура и состав сведений реестра
- III. Требования к порядку и срокам включения в реестр сведений и документов
- IV. Перечень сведений, доступ к которым обеспечивается всем заинтересованным лицам на бесплатной основе
ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ
ПОСТАНОВЛЕНИЕ
от 2 октября 2018 г. N 1169
О ВНЕСЕНИИ ИЗМЕНЕНИЯ
В ПОЛОЖЕНИЕ О ВОЗМЕЩЕНИИ ПРОЦЕССУАЛЬНЫХ ИЗДЕРЖЕК, СВЯЗАННЫХ
С ПРОИЗВОДСТВОМ ПО УГОЛОВНОМУ ДЕЛУ, ИЗДЕРЖЕК В СВЯЗИ
С РАССМОТРЕНИЕМ ДЕЛА АРБИТРАЖНЫМ СУДОМ, ГРАЖДАНСКОГО ДЕЛА,
АДМИНИСТРАТИВНОГО ДЕЛА, А ТАКЖЕ РАСХОДОВ В СВЯЗИ
С ВЫПОЛНЕНИЕМ ТРЕБОВАНИЙ КОНСТИТУЦИОННОГО
СУДА РОССИЙСКОЙ ФЕДЕРАЦИИ
Правительство Российской Федерации постановляет:
1. Абзацы первый и второй пункта 23 Положения о возмещении процессуальных издержек, связанных с производством по уголовному делу, издержек в связи с рассмотрением дела арбитражным судом, гражданского дела, административного дела, а также расходов в связи с выполнением требований Конституционного Суда Российской Федерации, утвержденного постановлением Правительства Российской Федерации от 1 декабря 2012 г. N 1240 «О порядке и размере возмещения процессуальных издержек, связанных с производством по уголовному делу, издержек в связи с рассмотрением дела арбитражным судом, гражданского дела, административного дела, а также расходов в связи с выполнением требований Конституционного Суда Российской Федерации и о признании утратившими силу некоторых актов Совета Министров РСФСР и Правительства Российской Федерации» (Собрание законодательства Российской Федерации, 2012, N 50, ст. 7058; 2016, N 7, ст. 974), заменить текстом следующего содержания:
«23. Размер вознаграждения адвоката, участвующего в уголовном деле по назначению дознавателя, следователя или суда, составляет за один рабочий день участия:
с 2019 года — не менее 900 рублей и не более 1550 рублей, а в ночное время — в размере не менее 1175 рублей и не более 2150 рублей;
с 2020 года — не менее 1250 и не более 1900 рублей, а в ночное время — в размере не менее 1525 рублей и не более 2500 рублей;
с 2021 года — не менее 1500 рублей и не более 2150 рублей, а в ночное время — в размере не менее 1775 рублей и не более 3025 рублей.
Размер вознаграждения адвоката, участвующего в уголовном деле по назначению дознавателя, следователя или суда, за один день участия, являющийся нерабочим праздничным днем или выходным днем, включая ночное время, составляет:
с 2019 года — не менее 1450 рублей и не более 2750 рублей;
с 2020 года — не менее 1800 рублей и не более 3100 рублей;
с 2021 года — не менее 2050 рублей и не более 3350 рублей.».
2. Настоящее постановление вступает в силу с 1 января 2019 г.
Председатель Правительства
Российской Федерации
Д.МЕДВЕДЕВ
1. Утвердить прилагаемые Правила хранения лекарственных средств для ветеринарного применения.
2. Настоящий приказ вступает в силу с 1 июля 2015 года.
| Министр | Н.В. Федоров |
Зарегистрировано в Минюсте РФ 5 мая 2015 г.
Регистрационный № 37117
Приложение
к приказу Министерства
сельского хозяйства РФ
от 15 апреля 2015 г. № 145
Правилахранения лекарственных средств для ветеринарного применения
1. Настоящие Правила устанавливают требования к помещениям для хранения лекарственных средств для ветеринарного применения (далее — лекарственные средства), определяют условия хранения лекарственных средств и распространяются на производителей лекарственных средств, организации оптовой торговли лекарственными средствами, ветеринарные аптечные организации, индивидуальных предпринимателей, ветеринарные организации и иные организации, осуществляющие обращение лекарственных средств для ветеринарного применения (далее соответственно — организации, индивидуальные предприниматели).
II. Общие требования к помещениям для хранения лекарственных средств и организации хранения лекарственных средств
2. Устройство, состав, размеры площадей, эксплуатация и оборудование помещений для хранения лекарственных средств должны обеспечивать их сохранность с учетом физико-химических, фармакологических и токсикологических свойств, а также требований нормативных документов на лекарственные средства, установленных производителями лекарственных средств, и/или общих фармакопейных статей, и/или фармакопейных статей.
3. Внутренние поверхности ограждающих конструкций (стены, перегородки, потолки) в помещениях для хранения лекарственных средств должны быть гладкими и допускать возможность проведения влажной уборки. Полы в помещениях для хранения лекарственных средств должны быть сплошными, твердыми и ровными, иметь не образующее пыль покрытие, устойчивое к воздействию механической и влажной уборки с использованием дезинфицирующих средств, не должны иметь деревянных неокрашенных поверхностей.
4. Помещения для хранения лекарственных средств должны быть оснащены оборудованием, позволяющим обеспечить температурные и влажностные режимы хранения лекарственных средств в соответствии с условиями хранения, предусмотренными инструкциями по применению лекарственных препаратов для ветеринарного применения (далее — лекарственные препараты), или условиями хранения, указанными на первичной упаковке фармацевтических субстанций.
5. Помещения для хранения лекарственных средств должны иметь системы электроснабжения, отопления, быть оборудованы системой принудительной или естественной вентиляции. Не допускается обогревание помещений газовыми приборами с открытым пламенем или электронагревательными приборами с открытой электроспиралью.
6. Помещения для хранения лекарственных средств должны быть оборудованы стеллажами, шкафами, поддонами (подтоварниками). Не допускается хранение лекарственных средств на полу без поддона.
Поддоны могут располагаться на полу в один ряд или на стеллажах в несколько ярусов в зависимости от высоты стеллажа. Не допускается размещение поддонов с лекарственными средствами в несколько рядов по высоте без использования стеллажей.
7. В помещениях для хранения лекарственных средств стеллажи (шкафы) должны быть установлены таким образом, чтобы обеспечить свободный доступ к лекарственным средствам персонала и, при необходимости, погрузочных устройств, а также доступность стеллажей (шкафов), стен, пола для уборки. Стеллажи для хранения лекарственных средств в помещениях площадью более * должны быть установлены следующим образом:
расстояние до наружных стен — не менее 0,6 м;
расстояние до потолка — не менее 0,5 м;
расстояние от пола — не менее 0,25 м;
проходы между стеллажами — не менее 0,75 м.
8. Стеллажи, шкафы и полки в них, предназначенные для хранения лекарственных средств, должны быть пронумерованы и промаркированы. Поддоны (подтоварники), предназначенные для хранения лекарственных средств, должны быть промаркированы.
На стеллажах и шкафах должна быть прикреплена стеллажная карта с указанием наименований лекарственных средств, номера серии, срока годности, количества единиц хранения. При использовании компьютерных технологий допускается отсутствие стеллажных карт при условии идентификации хранимых лекарственных средств при помощи кодов и электронных устройств.
При хранении лекарственных средств в ветеринарных организациях и организациях, осуществляющих разведение, выращивание и содержание животных, в стеллажных картах указываются группы лекарственных средств, систематизированные способами, перечисленными в пункте 13 настоящих Правил.
9. Лекарственные препараты во вторичной (потребительской) упаковке, фармацевтические субстанции в первичной упаковке должны храниться в шкафах, на стеллажах или полках этикеткой (маркировкой) наружу.
10. Помещения для хранения лекарственных средств, требующих защиты от воздействия повышенной температуры» должны быть оснащены холодильным оборудованием, укомплектованным термометрами (термографами, терморегистраторами).
11. Помещения для хранения лекарственных средств должны быть оснащены приборами для регистрации параметров воздуха (термометрами, гигрометрами (электронными гигрометрами) или психрометрами). В помещениях для хранения лекарственных средств площадью более * измерительные части этих приборов должны размещаться на расстоянии не менее 3 м от дверей, окон и отопительных приборов.
Приборы и (или) части приборов, с которых производится визуальное считывание показаний, должны располагаться в доступном для персонала месте на высоте 1,5 — 1,7 м от пола.
12. Показания приборов для регистрации параметров воздуха (термометров, гигрометров (электронных гигрометров) или психрометров) должны регистрироваться 2 раза в день в журнале (карте) регистрации параметров воздуха на бумажном носителе или в электронном виде с архивацией (для электронных гигрометров), который ведется лицом, ответственным за хранение лекарственных средств. Журнал (карта) регистрации заводится на один календарный год. Журнал (карта) регистрации хранится в течение одного календарного года, следующего за годом ведения журнала (карты) регистрации. Приборы для регистрации параметров воздуха должны быть сертифицированы, калиброваны и подвергаться поверке в установленном порядке.
13. При хранении лекарственных средств используются следующие способы систематизации:
по фармакологическим группам;
по способу применения (внутреннее, наружное);
в алфавитном порядке;
с учетом агрегатного состояния фармацевтических субстанций (жидкие, сыпучие, газообразные).
При размещении лекарственных средств допускается использование компьютерных технологий (по кодам).
Способ организации хранения лекарственных средств утверждается приказом руководителя организации или индивидуальным предпринимателем и доводится до сведения персонала.
наркотические и психотропные лекарственные средства, прекурсоры;
сильнодействующие и ядовитые лекарственные средства, находящиеся под контролем в соответствии с международными правовыми нормами.
15. Организации и индивидуальные предприниматели должны вести учет лекарственных средств с ограниченным сроком годности на бумажном носителе или в электронном виде с архивацией. Контроль за своевременной реализацией лекарственных средств с ограниченным сроком годности должен осуществляться с использованием компьютерных технологий и/или стеллажных карт с указанием наименования лекарственного средства, серии, срока годности либо журналов учета сроков годности. Порядок ведения учета указанных лекарственных средств устанавливается руководителем организации или индивидуальным предпринимателем.
16. При выявлении лекарственных средств с истекшим сроком годности, в поврежденной упаковке, недоброкачественных, фальсифицированных или контрафактных лекарственных средств они должны храниться отдельно от других групп лекарственных средств в специально выделенной и обозначенной (карантинной) зоне или в специальном контейнере не более 3 месяцев с целью уничтожения таких лекарственных средств в соответствии с Правилами уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств, утвержденных постановлением Правительства Российской Федерации от 3 сентября 2010 г. № 674 (Собрание законодательства Российской Федерации, 2010, № 37, ст. 4689; 2012, № 37, ст. 5002).
17. Помещения и оборудование для хранения лекарственных средств подлежат обязательному ежедневному мытью с применением моющих средств.
18. В помещениях для хранения лекарственных средств допускается хранение веществ, оборудования и материалов, предназначенных для оказания ветеринарной (медицинской) помощи, ухода за животными, уборки помещений, а также дезинфекции, дезинсекции и дератизации. Указанные вещества, оборудование и материалы должны храниться отдельно от мест хранения лекарственных средств.
19. Доступ посторонних лиц к местам хранения лекарственных средств не допускается.
20. При хранении лекарственных средств учитываются требования законодательства Российской Федерации в сфере обращения лекарственных средств и сфере пожарной безопасности.
III. Особенности организации хранения лекарственных средств в складских помещениях
21. Хранение лекарственных средств осуществляется в соответствии с требованиями настоящих Правил с учетом следующих особенностей организации хранения лекарственных средств в складских помещениях.
22. Лекарственные средства, хранящиеся в складских помещениях, должны размещаться на стеллажах или на подтоварниках (поддонах).
23. При ручном способе разгрузочно-погрузочных работ высота размещения лекарственных средств не должна превышать 1,5 метра.
При использовании механизированных устройств для проведения разгрузочно-погрузочных работ общая высота размещения лекарственных средств на стеллажах должна обеспечивать возможность проведения указанных работ.
IV. Требования к помещениям для хранения пожаровзрывоопасных и пожароопасных лекарственных средств и организации их хранения
24. Хранение пожаровзрывоопасных и пожароопасных лекарственных средств должно осуществляться с учетом их физико-химических свойств (например, способность к окислению, самонагреванию и воспламенению при попадании влаги, соприкосновении с воздухом).
25. Для хранения пожаровзрывоопасных и пожароопасных лекарственных средств должны выделяться изолированные помещения.
Места размещения изолированных помещений в зданиях (сооружениях), объемно-планировочные решения, направленные на ограничение распространения пожара, а также способы противопожарной защиты должны определяться на основании законодательства Российской Федерации в сфере обращения лекарственных средств и сфере пожарной безопасности с учетом категории помещений по взрывопожарной и пожарной опасности.
26. Складские помещения должны быть оборудованы несгораемыми шкафами, стеллажами и поддонами, рассчитанными на соответствующую нагрузку. Стеллажи устанавливаются на расстоянии 0,25 м от пола и 0,6 м от стен, ширина стеллажей не должна превышать 1 м и иметь, в случае хранения фармацевтических субстанций, отбортовки не менее 0,25 м. Продольные проходы между стеллажами должны быть не менее 1,35 м.
27. В помещениях для изготовления лекарственных препаратов допускается хранение пожаровзрывоопасных и пожароопасных лекарственных средств в количестве, необходимом для фасовки и изготовления лекарственных препаратов в течение одной рабочей смены. При этом емкости, в которых они хранятся, должны быть плотно закрыты. Оставшееся количество пожаровзрывоопасных и пожароопасных лекарственных средств по окончании работы в конце смены передается следующей смене или возвращается на место основного хранения.
28. В ветеринарных аптечных организациях и у индивидуальных предпринимателей допускается хранение лекарственных препаратов, обладающих легковоепламеняющимися и горючими свойствами, в объеме до 10 кг вне помещений для хранения пожаровзрывоопасных и пожароопасных лекарственных средств во встроенных несгораемых шкафах. Шкафы должны быть удалены от тепловыводящих поверхностей и проходов, иметь двери шириной не менее 0,7 м и высотой не менее 1,2 м. К ним должен быть организован свободный доступ.
Допускается хранение пожаровзрывоопасных лекарственных препаратов для использования на одну рабочую смену в металлических шкафах вне помещений для хранения пожаровзрывоопасных и пожароопасных лекарственных средств.
29. Количество пожароопасных лекарственных средств, допустимое для хранения в помещениях для хранения пожаровзрывоопасных и пожароопасных лекарственных средств, расположенных в зданиях складского назначения, не должно превышать 100 кг в нерасфасованном виде.
30. Помещения для хранения пожаровзрывоопасных и пожароопасных лекарственных средств в количестве свыше 100 кг, должны находиться в отдельно стоящем здании, при этом фармацевтические субстанции должны храниться в стеклянной или металлической таре изолированно от других групп лекарственных средств.
31. В помещения для хранения пожаровзрывоопасных и пожароопасных лекарственных средств запрещается входить с открытыми источниками огня.
V. Особенности хранения отдельных групп лекарственных средств в зависимости от физических и физико-химических свойств, воздействия на них различных факторов внешней среды
32. Лекарственные средства, требующие защиты от действия света, должны храниться в помещениях или специально оборудованных местах, обеспечивающих защиту от естественного и искусственного освещения.
33. Фармацевтические субстанции, требующие защиты от действия света, следует хранить в таре из светозащитных материалов (стеклянной таре из темного стекла, металлической таре, упаковке из алюминиевой фольги или полимерных материалов, окрашенных в темный цвет).
34. Особо чувствительные к свету фармацевтические субстанции должны храниться в черной светонепроницаемой таре.
35. Лекарственные препараты, требующие защиты от действия света, упакованные в первичную и вторичную (потребительскую) упаковку, следует хранить в шкафах или на стеллажах при условии принятия мер для предотвращения попадания на указанные лекарственные препараты прямого солнечного света или иного яркого направленного света (использование светоотражающей пленки, жалюзи, козырьков и др.).
Хранение лекарственных средств, требующих защиты от воздействия влаги
36. Лекарственные средства, требующие защиты от воздействия влаги, следует хранить в помещении с температурой воздуха не выше +15°С, в герметичной таре из материалов, непроницаемых для паров воды.
Фармацевтические субстанции с выраженными гигроскопическими свойствами следует хранить в стеклянной таре с герметичной крышкой.
Во избежание порчи и потери качества хранение лекарственных средств, требующих защиты от воздействия влаги, следует организовать в соответствии с условиями хранения, предусмотренными инструкциями по применению лекарственных препаратов, или условиями хранения, указанными на первичной упаковке фармацевтических субстанций.
Хранение лекарственных средств, требующих защиты от улетучивания и высыхания
37. Лекарственные средства, требующие защиты от улетучивания и высыхания (собственно летучие лекарственные средства; лекарственные средства, содержащие летучий растворитель (спиртовые настойки, жидкие спиртовые концентраты, густые экстракты); растворы и смеси летучих веществ (эфирные масла, растворы аммиака, формальдегида, хлористого водорода свыше 13%, карболовой кислоты, этиловый спирт различной концентрации); лекарственное растительное сырье, содержащее эфирные масла; лекарственные средства, содержащие кристаллизационную воду, — кристаллогидраты; лекарственные средства, разлагающиеся с образованием летучих продуктов; лекарственные средства с определенным нижним пределом влагосодержания) следует хранить в помещении с температурой воздуха не выше +15°С, в герметичной таре из непроницаемых для улетучивающихся веществ материалов в соответствии с инструкциями по применению лекарственных препаратов, и условиями, указанными на вторичной (потребительской) упаковке — для лекарственных препаратов, на первичной упаковке — для фармацевтических субстанций.
38. Фармацевтические субстанции, содержащие кристаллизационную воду, следует хранить в помещении с температурой воздуха не выше +15°С при относительной влажности воздуха 50-65%.
Хранение лекарственных средств, требующих защиты от воздействия повышенной температуры
39. Хранение лекарственных средств, требующих защиты от воздействия повышенной температуры (термолабильные лекарственные средства), должно осуществляться в соответствии с условиями хранения, предусмотренными инструкциями по применению лекарственных препаратов, или условиями хранения, указанными на первичной упаковке фармацевтических субстанций.
40. Биологические лекарственные препараты одного и того же наименования должны храниться по сериям с учетом срока их годности. Не допускается хранение биологических лекарственных препаратов на дверной панели холодильника.
41. Антибиотики следует хранить в промышленной упаковке при комнатной температуре (*), если отсутствуют другие указания в инструкции по применению лекарственных препаратов, или на первичной упаковке фармацевтических субстанций.
42. Органопрепараты следует хранить в защищенном от света, сухом месте при температуре от 0 до +15°С, если отсутствуют другие указания в инструкции по применению лекарственного препарата.
43. Масла должны храниться при температуре от 44 до +12°С, если отсутствуют другие указания в инструкции по применению лекарственных препаратов, или на первичной упаковке фармацевтических субстанций.
44. Загрузка холодильного оборудования (холодильников, холодильных витрин, камер, комнат) должна обеспечивать свободную циркуляцию воздуха в помещении для хранения лекарственных средств.
Хранение лекарственных средств, требующих защиты от воздействия пониженной температуры
45. К лекарственным средствам, требующим защиты от воздействия пониженной температуры, относятся лекарственные средства, физико-химическое состояние которых после замерзания изменяется и при последующем нагревании до комнатной температуры (*) не восстанавливается (40% раствор формальдегида (формалин), ледяная уксусная кислота, жирные масла, растворы инсулина и другие).
Хранение лекарственных средств, требующих защиты от воздействия пониженной температуры, осуществляется в соответствии с температурным режимом, указанным в инструкциях по применению лекарственных препаратов, на вторичной (потребительской) упаковке — для лекарственных препаратов, на первичной упаковке — для фармацевтических субстанций.
Замерзание препаратов, требующих защиты от воздействия пониженной температуры, не допускается.
Хранение лекарственных средств, требующих защиты от воздействия газов, содержащихся в окружающей среде
46. Лекарственные средства, требующие защиты от воздействия газов, находящихся в окружающей среде (вещества, реагирующие с кислородом воздуха; вещества, реагирующие с углекислым газом воздуха), следует хранить в герметически закрытой таре из материалов, непроницаемых для газов, по возможности заполненной доверху.
Хранение пахучих и красящих лекарственных средств
47. Пахучие лекарственные средства следует хранить в герметически закрытой таре, непроницаемой для запаха, раздельно по наименованиям.
48. Красящие лекарственные средства (оставляющие окрашенный след, не смываемый обычной санитарно-гигиенической обработкой, на таре, укупорочных средствах, оборудовании и инвентаре) следует хранить в специальном шкафу в плотно укупоренной таре, раздельно по наименованиям.
Для работы с красящими лекарственными средствами для каждого наименования необходимо выделять отдельные весы, ступку, шпатель и другой необходимый инвентарь.
Хранение антисептических лекарственных средств
49. Антисептические лекарственные средства следует хранить в герметичной таре изолированно от мест хранения пластмассовых, резиновых и металлических изделий и мест получения дистиллированной воды.
Хранение лекарственного растительного сырья
50. Лекарственное растительное сырье (предварительно высушенное) должно храниться в сухом, хорошо вентилируемом помещении, в герметически закрытой таре.
51. Лекарственное растительное сырье, содержащее эфирные масла, необходимо хранить изолированно в герметически закрытой таре.
52. Лекарственное растительное сырье должно подвергаться периодическому контролю в форме оценки по органолептическим показателям. Трава, корни, корневища, семена, плоды, утратившие свойственную им окраску, запах, а также пораженные плесенью, вредителями, не допускаются к дальнейшему хранению и использованию.
Хранение пожароопасных лекарственных средств
53. Хранение пожароопасных лекарственных средств (лекарственные средства, обладающие легковоспламеняющимися свойствами; лекарственные средства, обладающие легкогорючими свойствами) должно осуществляться отдельно от других лекарственных средств.
54. В целях предупреждения испарения жидкостей из сосудов, легковоспламеняющиеся лекарственные средства должны храниться в герметически закрытой стеклянной или металлической таре.
55. Емкости объемом более 5 литров с легковоспламеняющимися и легкогорючими лекарственными средствами должны храниться на полках стеллажей в один ряд по высоте. Запрещается их хранение в несколько рядов по высоте с использованием различных прокладочных материалов.
56. Не допускается хранение пожароопасных лекарственных средств на расстоянии менее 1 метра от отопительных приборов.
57. Хранение бутылей с легковоспламеняющимися и легкогорючими лекарственными средствами должно осуществляться в таре, предохраняющей от ударов, или в баллоноопрокидывателях в один ряд.
58. Не допускается хранение легковоспламеняющихся и легкогорючих лекарственных средств в полностью заполненной таре. Заполнение тары не должно превышать 90% объема. Спирты в объеме более 5 литров хранятся в металлических емкостях, заполняемых не более чем на 75% объема.
59. Не допускается совместное хранение легковоспламеняющихся лекарственных средств с минеральными кислотами, сжатыми и сжиженными газами, легкогорючими веществами, щелочами, а также с неорганическими солями, дающими с органическими веществами взрывоопасные смеси.
60. Эфир медицинский и эфир для наркоза следует хранить в промышленной упаковке, в помещении с температурой воздуха не выше +15°С в защищенном от света месте, на расстоянии не менее 1 метра от отопительных приборов.
Хранение пожаровзрывоопасных лекарственных средств
61. При хранении пожаровзрывоопасных лекарственных средств (лекарственные средства, обладающие взрывчатыми свойствами (например, нитроглицерин); лекарственных средств, обладающих взрывоопасными свойствами (например, калия перманганат, серебра нитрат) следует принимать меры против загрязнения их пылью.
62. Емкости с пожаровзрывоопасными лекарственными средствами необходимо плотно закрывать во избежание попадания паров этих средств в воздух.
63. Хранение нерасфасованного калия перманганата допускается в специальном отсеке складских помещений в жестяных барабанах. В ветеринарных аптечных организациях, в ветеринарных организациях и у индивидуальных предпринимателей калия перманганат должен храниться в штангласах с притертыми пробками, штангласы должны располагаться отдельно от других веществ.
64. Нерасфасованный раствор нитроглицерина должен храниться в герметически закрытой, стеклянной или металлической таре, в помещении с температурой воздуха не выше +15°С в защищенном от света месте, с соблюдением мер предосторожности от огня. Передвигать тару с нитроглицерином и отвешивать препарат следует в условиях, исключающих пролив и испарение нитроглицерина, а также попадание его на кожу.
65. При работе с диэтиловым спиртом не допускается встряхивание, удары, трение.
66. Запрещается хранение взрывоопасных лекарственных средств с кислотами и щелочами.
Хранение наркотических и психотропных лекарственных средств
67. Наркотические и психотропные лекарственные средства хранятся в организациях в изолированных помещениях, специально оборудованных инженерными и техническими средствами охраны, и в местах временного хранения с соблюдением требований, установленных Правилами хранения наркотических средств, психотропных веществ и их прекурсоров, утвержденными постановлением Правительства Российской Федерации от 31 декабря 2009 г. № 1148 (Собрание законодательства Российской Федерации, 2010, № 4, ст. 394; № 25, ст. 3178; 2011, № 18, ст. 2649; № 42, ст. 5922; № 51, ст. 7534; 2012, № 1, ст. 130; № 27, ст. 3764; № 37, ст. 5002; 2013, № 8, ст. 831; 2014, № 15, ст. 1752).
Хранение сильнодействующих и ядовитых лекарственных средств
68. Сильнодействующие и ядовитые лекарственные средства, содержащие сильнодействующие и ядовитые вещества, включенные в список сильнодействующих веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации и в список ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации, утвержденные постановлением Правительства Российской Федерации от 29 декабря 2007 г. № 964 (Собрание законодательства Российской Федерации, 2008, № 2, ст. 89; 2010, № 28, ст. 3703; 2012, № 10, ст. 1232; № 41, ст. 5625; № 2013, № 6, ст. 558; № 9, ст. 953; № 45, ст. 5831), хранятся в соответствии с пунктами 69 — 79 настоящих Правил.
69. Лицом, ответственным за хранение, учет и отпуск сильнодействующих и ядовитых лекарственных средств, является руководитель организации или индивидуальный предприниматель, либо назначенное им лицо из числа работающих в этой организации или у индивидуального предпринимателя ветеринарных врачей (провизоров), а при отсутствии ветеринарных врачей — ветеринарных фельдшеров (фармацевтов) со средним профессиональным образованием.
70. Руководитель организации, индивидуальный предприниматель обязан ознакомить под расписку лиц, ответственных за хранение, учет и отпуск сильнодействующих и ядовитых лекарственных средств, с правилами обращения с указанными средствами.
71. Помещения, предназначенные для хранения сильнодействующих и ядовитых лекарственных средств, оборудуются входной металлической дверью, деревянной дверью, усиленной с двух сторон листовым железом, либо дверью из иного материала, обладающей классом защиты от разрушающих воздействий не ниже третьего.
72. Хранение ядовитых лекарственных средств допустимо только в отдельном помещении.
73. Сильнодействующие лекарственные средства разрешается хранить в одном помещении с другими (не сильнодействующими) лекарственными средствами, но обязательно в отдельных шкафах и под замком.
74. Сильнодействующие и ядовитые лекарственные средства подлежат хранению в специально выделенных для этой цели сейфах, металлических или обитых железом деревянных шкафах или ящиках под замком. На внешней стороне двери сейфа (шкафа, ящика) для хранения сильнодействующих и ядовитых препаратов необходимо наличие соответствующей надписи «Сильнодействующие/ядовитые лекарственные средства». На внутренней стороне двери сейфа (шкафа, ящика) должен быть прикреплен список хранящихся в нем сильнодействующих и ядовитых лекарственных средств.
75. Сильнодействующие и ядовитые лекарственные средства в крупногабаритной таре (например, контейнеры, бочки, бидоны, мешки) должны храниться на складах, оборудованных приточно-вытяжной вентиляцией, средствами пожаротушения и сигнализации.
76. Сильнодействующие и ядовитые лекарственные средства должны храниться раздельно по группам на отдельных полках шкафов (сейфов) в зависимости от способа их применения.
77. Шкафы, сейфы и ящики, в которых хранятся ядовитые лекарственные средства, после окончания рабочего дня запираются на замок, а также опечатываются или пломбируются. Помещения и склады запираются на замок, опечатываются или пломбируются.
78. Ключи, пломбир для опечатывания, пломбиратор хранятся у лица, ответственного за хранение, учет и отпуск сильнодействующих и ядовитых лекарственных средств.
79. Доступ в помещения для хранения сильнодействующих и ядовитых веществ разрешен только ответственным за хранение, учет и отпуск сильнодействующих и ядовитых лекарственных средств лицам, непосредственно работающим с ними, указанным в приказе руководителя организации, индивидуального предпринимателя.
Правительство Российской Федерации постановляет:
1. Утвердить прилагаемые изменения, которые вносятся в акты Правительства Российской Федерации по вопросу установления регулируемых цен (тарифов) в электроэнергетике.
2. Федеральной антимонопольной службе в 4-месячный срок привести свои нормативные правовые акты в соответствие с настоящим постановлением.
3. Признать утратившими силу:
абзацы третий — пятый подпункта «г» пункта 4 изменений, которые вносятся в акты Правительства Российской Федерации по вопросам функционирования розничных рынков электрической энергии, утвержденных постановлением Правительства Российской Федерации от 4 мая 2012 г. N 442 «О функционировании розничных рынков электрической энергии, полном и (или) частичном ограничении режима потребления электрической энергии» (Собрание законодательства Российской Федерации, 2012, N 23, ст. 3008);
подпункт «а» пункта 1 изменений, которые вносятся в акты Правительства Российской Федерации по вопросам изменения зон деятельности гарантирующих поставщиков, утвержденных постановлением Правительства Российской Федерации от 28 мая 2015 г. N 508 «О внесении изменений в некоторые акты Правительства Российской Федерации по вопросам изменения зон деятельности гарантирующих поставщиков» (Собрание законодательства Российской Федерации, 2015, N 23, ст. 3312).
| Председатель Правительства Российской Федерации |
М. Мишустин |
УТВЕРЖДЕНЫ
постановлением Правительства
Российской Федерации
от 7 марта 2020 г. N 246
Изменения,которые вносятся в акты Правительства Российской Федерации по вопросу установления регулируемых цен (тарифов) в электроэнергетике
1. Приложения N 4 и 5 к стандартам раскрытия информации субъектами оптового и розничных рынков электрической энергии, утвержденным постановлением Правительства Российской Федерации от 21 января 2004 г. N 24 «Об утверждении стандартов раскрытия информации субъектами оптового и розничных рынков электрической энергии» (Собрание законодательства Российской Федерации, 2004, N 4, ст. 282; 2019, N 6, ст. 527), изложить в следующей редакции:
«Приложение N 4
к стандартам раскрытия информации
субъектами оптового и розничных
рынков электрической энергии
(в редакции постановления
Правительства Российской Федерации
от 7 марта 2020 г. N 246)
(форма)
Информацияоб осуществлении технологического присоединения по договорам, заключенным за текущий год
| Категория заявителей | Количество договоров (штук) | Максимальная мощность (кВт) | Стоимость договоров (без НДС) (тыс. рублей) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 0,4 кВ | 1 — 20 кВ | 35 кВ и выше | 0,4 кВ | 1 — 20 кВ | 35 кВ и выше | 0,4 кВ | 1 — 20 кВ | 35 кВ и выше | ||
| До 15 кВт — всего | ||||||||||
| в том числе льготная категория* | ||||||||||
| От 15 до 150 кВт — всего | ||||||||||
| в том числе льготная категория** | ||||||||||
| От 150 кВт до 670 кВт — всего | ||||||||||
| в том числе по индивидуальному проекту | ||||||||||
| От 670 кВт — всего | ||||||||||
| в том числе по индивидуальному проекту | ||||||||||
* Заявители, оплачивающие технологическое присоединение своих энергопринимающих устройств в размере не более 550 рублей.
** Заявители — юридические лица или индивидуальные предприниматели, заключившие договор об осуществлении технологического присоединения по одному источнику электроснабжения энергопринимающих устройств максимальной мощностью свыше 15 и до 150 кВт включительно (с учетом ранее присоединенных энергопринимающих устройств), у которых в договоре предусматривается беспроцентная рассрочка платежа за технологическое присоединение в размере 95 процентов платы за технологическое присоединение с условием ежеквартального внесения платы равными долями от общей суммы рассрочки до 3 лет со дня подписания сторонами акта об осуществлении технологического присоединения.
Приложение N 5
к стандартам раскрытия информации
субъектами оптового и розничных
рынков электрической энергии
(в редакции постановления
Правительства Российской Федерации
от 7 марта 2020 г. N 246)
(форма)
Информацияо поданных заявках на технологическое присоединение за текущий год
| Категория заявителей | Количество заявок (штук) | Максимальная мощность (кВт) | |||||
|---|---|---|---|---|---|---|---|
| 0,4 кВ | 1 — 20 кВ | 35 кВ и выше | 0,4 кВ | 1 — 20 кВ | 35 кВ и выше | ||
| До 15 кВт — всего | |||||||
| в том числе льготная категория* | |||||||
| От 15 до 150 кВт — всего | |||||||
| в том числе льготная категория** | |||||||
| От 150 кВт до 670 кВт — всего | |||||||
| в том числе по индивидуальному проекту | |||||||
| От 670 кВт — всего | |||||||
| в том числе по индивидуальному проекту | |||||||
* Заявители, оплачивающие технологическое присоединение своих энергопринимающих устройств в размере не более 550 рублей.
** Заявители — юридические лица или индивидуальные предприниматели, заключившие договор об осуществлении технологического присоединения по одному источнику электроснабжения энергопринимающих устройств максимальной мощностью свыше 15 и до 150 кВт включительно (с учетом ранее присоединенных энергопринимающих устройств), у которых в договоре предусматривается беспроцентная рассрочка платежа за технологическое присоединение в размере 95 процентов платы за технологическое присоединение с условием ежеквартального внесения платы равными долями от общей суммы рассрочки до 3 лет со дня подписания сторонами акта об осуществлении технологического присоединения.».
а) в абзаце тринадцатом пункта 12 слова «территориальных сетевых организаций, расходы которых впервые учитываются при утверждении в установленном порядке тарифов на услуги по передаче электрической энергии по электрическим сетям, принадлежащим на праве собственности или на ином законном основании территориальным сетевым организациям» заменить словами «организаций, расходы которых впервые учитываются при утверждении в установленном порядке цен (тарифов) в сфере электроэнергетики»;
б) в подпункте 7 пункта 18 слова «, за исключением расходов сетевых организаций на установку приборов учета в соответствии с законодательством Российской Федерации об энергосбережении и о повышении энергетической эффективности для потребителей услуг» исключить;
в) абзац шестой пункта 32 признать утратившим силу;
г) в пункте 34:
предложение первое абзаца первого после слов «в соответствии с законодательством Российской Федерации об электроэнергетике,» дополнить словами «расходы на выполнение предусмотренных пунктом 5 статьи 37 Федерального закона «Об электроэнергетике» обязанностей сетевой организации по обеспечению коммерческого учета электрической энергии (мощности), не относящиеся к капитальным вложениям, до начала очередного долгосрочного периода регулирования,»;
д) дополнить пунктами 34.1 — 34.3 следующего содержания:
«34.1. Экономия расходов на оплату потерь электрической энергии, полученная сетевой организацией при осуществлении деятельности по передаче электрической энергии в результате проведения мероприятий по сокращению объема используемых энергетических ресурсов, учитывается в составе необходимой валовой выручки в течение 10 лет с начала периода регулирования, следующего за периодом, в котором указанная экономия была достигнута, при условии, что такие мероприятия не финансировались и не будут финансироваться за счет бюджетных средств.
34.2. Размер экономии расходов на оплату потерь электрической энергии, полученной сетевой организацией в соответствии с пунктом 34.1 настоящего документа ( ), определяется в течение долгосрочного периода регулирования по формуле:
), определяется в течение долгосрочного периода регулирования по формуле:

где:
N — уровень потерь электрической энергии при ее передаче по электрическим сетям, установленный регулирующим органом на долгосрочный период регулирования, в процентах от величины суммарного отпуска электрической энергии в сеть сетевой организации;
 — величина суммарного отпуска электрической энергии в сеть сетевой организации (тыс. кВт);
— величина суммарного отпуска электрической энергии в сеть сетевой организации (тыс. кВт);
 —
— 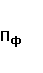 величина фактических потерь электрической энергии в сетях сетевой организации (тыс. кВт);
величина фактических потерь электрической энергии в сетях сетевой организации (тыс. кВт);
ЦП — фактически сложившаяся средневзвешенная цена покупки электрической энергии (мощности) в целях компенсации потерь электрической энергии при ее передаче по электрическим сетям (руб/кВт ч).
ч).
34.3. В случае если год, в котором была достигнута экономия расходов на оплату потерь электрической энергии, полученная сетевой организацией при осуществлении деятельности по передаче электрической энергии в результате проведения мероприятий по сокращению объема используемых энергетических ресурсов, относится к предыдущему долгосрочному периоду регулирования, указанная экономия (Э) рассчитывается по формуле:

где  — уровень потерь электрической энергии при ее передаче по электрическим сетям, установленный регулирующим органом на предыдущий долгосрочный период регулирования, в процентах от величины суммарного отпуска электрической энергии в сеть сетевой организации.»;
— уровень потерь электрической энергии при ее передаче по электрическим сетям, установленный регулирующим органом на предыдущий долгосрочный период регулирования, в процентах от величины суммарного отпуска электрической энергии в сеть сетевой организации.»;
е) пункт 38:
после абзаца двенадцатого дополнить абзацем следующего содержания:
«величина расходов на выполнение предусмотренных пунктом 5 статьи 37 Федерального закона «Об электроэнергетике» обязанностей сетевой организации по обеспечению коммерческого учета электрической энергии (мощности), не относящихся к капитальным вложениям, до начала очередного долгосрочного периода регулирования;»;
дополнить абзацем следующего содержания:
«Экономия расходов на оплату потерь электрической энергии, полученная сетевой организацией при осуществлении деятельности по передаче электрической энергии в результате проведения мероприятий по сокращению объема используемых энергетических ресурсов, учитывается в составе необходимой валовой выручки в течение 10 лет с начала периода регулирования, следующего за периодом, в котором указанная экономия была достигнута, при условии, что такие мероприятия не финансировались и не будут финансироваться за счет бюджетных средств, и рассчитывается в соответствии с пунктами 34.1 — 34.3 настоящего документа.»;
ж) в абзацах пятом и шестом пункта 48 слова «Южно-Якутский район Республики Саха (Якутия), Приморский край, Хабаровский край, Амурская область, Еврейская автономная область» заменить словами «территории, указанные в пункте IV приложения N 2 к Правилам оптового рынка электрической энергии и мощности, утвержденным постановлением Правительства Российской Федерации от 27 декабря 2010 г. N 1172 «Об утверждении Правил оптового рынка электрической энергии и мощности и о внесении изменений в некоторые акты Правительства Российской Федерации по вопросам организации функционирования оптового рынка электрической энергии и мощности»;
з) в абзаце четвертом пункта 49 слова «Амурская область, Приморский край, Хабаровский край, Южно-Якутский район Республики Саха (Якутия), Еврейская автономная область» заменить словами «территории, указанные в пункте IV приложения N 2 к Правилам оптового рынка электрической энергии и мощности, утвержденным постановлением Правительства Российской Федерации от 27 декабря 2010 г. N 1172 «Об утверждении Правил оптового рынка электрической энергии и мощности и о внесении изменений в некоторые акты Правительства Российской Федерации по вопросам организации функционирования оптового рынка электрической энергии и мощности»;
и) в пункте 61:
в абзаце четвертом слова «осуществляется на второе полугодие 2012 г. однократно, а на IV квартал 2012 г. и начиная с 2013 г.», предложение второе, а также слова «(на второе полугодие 2012 г. — не позднее 1 июня, а в части определения прогнозных объемов поставки электрической энергии и (или) мощности на оптовый рынок — до 1 июля)» исключить;
абзац пятый признать утратившим силу;
к) в абзаце пятом пункта 65 слова «внереализационные расходы на списание безнадежной к взысканию дебиторской задолженности сетевых организаций» заменить словами «расходы на выполнение предусмотренных пунктом 5 статьи 37 Федерального закона «Об электроэнергетике» обязанностей гарантирующего поставщика по обеспечению коммерческого учета электрической энергии (мощности), в том числе не относящиеся к капитальным вложениям»;
л) в пункте 87:
в абзаце первом слова «и расходов на строительство объектов электросетевого хозяйства — от существующих объектов электросетевого хозяйства до присоединяемых энергопринимающих устройств и (или) объектов электроэнергетики» заменить словами «расходов на обеспечение средствами коммерческого учета электрической энергии (мощности) и расходов на строительство объектов электросетевого хозяйства — от существующих объектов электросетевого хозяйства до присоединяемых энергопринимающих устройств и (или) объектов электроэнергетики»;
второе предложение абзаца шестого изложить в следующей редакции: «Дифференциация стандартизированных тарифных ставок определяется в соответствии с предусмотренным методическими указаниями по определению размера платы за технологическое присоединение к электрическим сетям перечнем стандартизированных тарифных ставок с разбивкой по составу мероприятий по технологическому присоединению, обусловленных в том числе видами и техническими характеристиками объектов электросетевого хозяйства, уровнем напряжения в точке присоединения энергопринимающих устройств, а также максимальной мощностью присоединяемых энергопринимающих устройств.»;
в абзаце одиннадцатом слова «с разбивкой по составу мероприятий по технологическому присоединению, обусловленных в том числе видами и техническими характеристиками объектов электросетевого хозяйства, уровнем напряжения в точке присоединения энергопринимающих устройств, максимальной мощностью присоединяемых энергопринимающих устройств и категорией надежности энергоснабжения, и по иным установленным федеральными законами основаниям» заменить словами «согласно перечню стандартизированных тарифных ставок, предусмотренному методическими указаниями по определению размера платы за технологическое присоединение к электрическим сетям».
В соответствии с частью 3 статьи 50.1 Градостроительного кодекса Российской Федерации Правительство Российской Федерации постановляет:
1. Утвердить прилагаемые Правила формирования единого государственного реестра заключений экспертизы проектной документации объектов капитального строительства.
3. Министерству строительства и жилищно-коммунального хозяйства Российской Федерации обеспечить:
а) создание, развитие и ввод в эксплуатацию государственной информационной системы «Единый государственный реестр заключений экспертизы проектной документации объектов капитального строительства»;
б) с 1 января 2018 г. формирование и ведение единого государственного реестра заключений экспертизы проектной документации объектов капитального строительства с использованием государственной информационной системы, указанной в подпункте «а» настоящего пункта.
4. Установить, что реализация полномочий, предусмотренных настоящим постановлением, осуществляется в пределах установленной Правительством Российской Федерации предельной штатной численности работников центрального аппарата Министерства строительства и жилищно-коммунального хозяйства Российской Федерации и бюджетных ассигнований, предусмотренных Министерству в федеральном бюджете на руководство и управление в сфере установленных функций.
5. Пункты 1 и 2 настоящего постановления вступают в силу с 1 января 2018 г.
| Председатель Правительства Российской Федерации |
Д. Медведев |
УТВЕРЖДЕНЫ
постановлением Правительства
Российской Федерации
от 24 июля 2017 г. № 878
Правилаформирования единого государственного реестра заключений экспертизы проектной документации объектов капитального строительства
1. Настоящие Правила устанавливают порядок формирования единого государственного реестра заключений экспертизы проектной документации объектов капитального строительства (далее — реестр), в том числе:
а) структуру и состав сведений реестра, включая перечень сведений, доступ к которым обеспечивается всем заинтересованным лицам на бесплатной основе;
б) требования к порядку и срокам включения в реестр сведений о заключениях экспертизы проектной документации и (или) результатов инженерных изысканий (далее — экспертиза), выданных органами и организациями, указанными в части 3 статьи 50.1 Градостроительного кодекса Российской Федерации (далее — экспертные организации), и сведений о документах, представленных для проведения экспертизы (далее соответственно — сведения, документы).
2. Действие настоящих Правил не распространяется на отношения, связанные с включением в реестр сведений и документов, составляющих государственную тайну.
3. Формирование реестра осуществляется в электронном виде с использованием государственной информационной системы «Единый государственный реестр заключений экспертизы проектной документации объектов капитального строительства».
4. Ведение реестра, в том числе включение в реестр (исключение из реестра) сведений, осуществляет Министерство строительства и жилищно-коммунального хозяйства Российской Федерации или определенное этим Министерством подведомственное ему государственное (бюджетное или автономное) учреждение (далее — оператор).
II. Структура и состав сведений реестра
5. В реестр включаются следующие систематизированные сведения:
а) о заключениях экспертизы;
б) о представленной для проведения экспертизы проектной документации, о проектной документации повторного использования, в том числе об экономически эффективной проектной документации повторного использования;
в) о представленных для проведения экспертизы результатах инженерных изысканий.
6. Заключения экспертизы и документы являются неотъемлемой частью реестра.
7. Для каждого заключения экспертизы в реестре создается раздел, который идентифицируется неизменяемым, не повторяющимся во времени и на территории Российской Федерации номером заключения экспертизы.
8. Каждый раздел реестра включает в себя следующие подразделы:
а) заключение экспертизы;
б) сведения, содержащиеся в документах, представленных для проведения экспертизы проектной документации;
в) сведения, содержащиеся в документах, представленных для проведения экспертизы результатов инженерных изысканий.
9. В подраздел, касающийся заключения экспертизы, включаются следующие сведения:
а) номер заключения экспертизы;
б) дата заключения экспертизы;
в) форма экспертизы (государственная экспертиза или негосударственная экспертиза);
г) сведения об объекте экспертизы (вид объекта (проектная документация и результаты инженерных изысканий, проектная документация, результаты инженерных изысканий) и его наименование);
д) результат проведенной экспертизы (положительное или отрицательное заключение экспертизы);
е) сведения об экспертной организации;
ж) сведения об экспертах, подписавших заключение экспертизы (фамилия, имя, отчество (при наличии), направление деятельности эксперта, указанное в квалификационном аттестате, должность);
з) сведения о лице, утвердившем заключение экспертизы (фамилия, имя, отчество (при наличии), должность);
и) особые отметки, включая сведения о признании заключения экспертизы недействительным;
к) источник финансирования (в случае если финансирование работ предполагается осуществлять полностью или частично за счет средств бюджетов бюджетной системы Российской Федерации, указывается соответствующий уровень бюджета бюджетной системы Российской Федерации в соответствии со статьей 10 Бюджетного кодекса Российской Федерации, в случае если финансирование работ предполагается осуществлять полностью или частично за счет средств юридических лиц, созданных Российской Федерацией, субъектом Российской Федерации, муниципальным образованием, юридических лиц, доля в уставном (складочном) капитале которых Российской Федерации, субъекта Российской Федерации, муниципального образования составляет более 50 процентов, указывается соответствующее юридическое лицо) и размер финансирования (в процентном отношении к полной стоимости проекта).
10. Заключение экспертизы является неотъемлемой частью подраздела, касающегося заключения экспертизы.
11. В подраздел, касающийся сведений, содержащихся в документах, представленных для проведения экспертизы проектной документации, включаются следующие сведения:
а) наименование и адрес (местоположение) объекта капитального строительства, применительно к которому подготовлена проектная документация;
б) функциональное назначение объекта капитального строительства, применительно к которому подготовлена проектная документация, и его основные проектируемые технико-экономические показатели (в соответствии с проектной документацией);
в) сметная стоимость объекта капитального строительства (при наличии в проектной документации раздела «смета на строительство объектов капитального строительства») и сведения о проверке достоверности ее определения;
г) сведения о природных и иных условиях территории, на которой планируется осуществлять строительство (климатический район и
подрайон, ветровой район, снеговой район, интенсивность сейсмических воздействий, инженерно-геологические условия);
д) сведения о застройщике (техническом заказчике), обеспечившем подготовку проектной документации;
е) сведения об индивидуальных предпринимателях и (или) юридических лицах, подготовивших проектную документацию;
ж) сведения об использовании при подготовке проектной документации проектной документации повторного использования, в том числе экономически эффективной проектной документации повторного использования (дата и номер заключения экспертизы, выданного в отношении использованной проектной документации);
з) сведения о признании проектной документации экономически эффективной проектной документацией повторного использования в соответствии с решением Министерства строительства и жилищно-коммунального хозяйства Российской Федерации (дата и номер решения, сведения о лице, которому принадлежит исключительное право на проектную документацию либо право на ее многократное использование, в том числе для подготовки на ее основе проектной документации).
12. Проектная документация (в отношении которой выдано заключение экспертизы) и иные представленные для проведения экспертизы документы являются неотъемлемой частью подраздела, касающегося сведений, содержащихся в документах, представленных для проведения экспертизы проектной документации.
13. В подраздел, касающийся сведений, содержащихся в документах, представленных для проведения экспертизы результатов инженерных изысканий, включаются следующие сведения:
а) дата подготовки отчета по результатам инженерных изысканий;
б) виды работ по инженерным изысканиям;
в) сведения о местоположении района (площадки, трассы) проведения изысканий (субъект Российской Федерации, муниципальный район);
г) сведения о застройщике (техническом заказчике), обеспечившем проведение инженерных изысканий;
д) сведения об индивидуальных предпринимателях и (или) юридических лицах, подготовивших технический отчет по результатам инженерных изысканий.
14. Результаты инженерных изысканий (в отношении которых выдано заключение экспертизы) и иные представленные для проведения экспертизы результатов инженерных изысканий документы (за исключением случая одновременного проведения экспертизы проектной документации и результатов инженерных изысканий) являются неотъемлемой частью подраздела, касающегося сведений, содержащихся в документах, представленных для проведения экспертизы результатов инженерных изысканий.
а) в отношении физического лица — фамилия, имя, отчество (при наличии), страховой номер индивидуального лицевого счета в системе обязательного пенсионного страхования, почтовый адрес, адрес электронной почты (при наличии);
б) в отношении индивидуального предпринимателя — фамилия, имя, отчество (при наличии), основной государственный регистрационный номер индивидуального предпринимателя, почтовый адрес, адрес электронной почты (при наличии);
в) в отношении юридического лица, органа государственной власти, иного государственного органа, органа местного самоуправления — полное наименование, идентификационный номер налогоплательщика, основной государственный регистрационный номер, место нахождения и адрес, адрес электронной почты (при наличии).
III. Требования к порядку и срокам включения в реестр сведений и документов
16. Создание нового раздела реестра (внесение изменений в раздел реестра) осуществляется оператором на основании проекта раздела (части раздела) реестра, сформированного посредством государственной информационной системы «Единый государственный реестр заключений экспертизы проектной документации объектов капитального строительства»:
а) экспертной организацией;
б) Министерством строительства и жилищно-коммунального хозяйства Российской Федерации (в случае включения в реестр сведений о признании проектной документации экономически эффективной проектной документацией повторного использования).
17. В целях включения в реестр сведений и документов подготовка проекта раздела реестра осуществляется экспертной организацией не позднее рабочего дня со дня утверждения заключения экспертизы.
Подготовка проекта части раздела реестра в целях включения в него сведений, указанных в подпункте «з» пункта 11 настоящих Правил, осуществляется Министерством строительства и жилищно-коммунального хозяйства Российской Федерации в день принятия решения о признании проектной документации, сведения о которой включены в реестр, экономически эффективной проектной документацией повторного использования.
18. Включение в реестр сведений и документов (внесение изменений в раздел реестра) осуществляется оператором не позднее рабочего дня, следующего за днем регистрации в государственной информационной системе «Единый государственный реестр заключений экспертизы проектной документации объектов капитального строительства» проекта раздела (части раздела) реестра, сформированного лицами, указанными в подпунктах «а» и «б» пункта 16 настоящих Правил, в соответствии с порядком ведения реестра, устанавливаемым Министерством строительства и жилищно-коммунального хозяйства Российской Федерации.
19. В случае формирования проекта раздела (части раздела) реестра с нарушением порядка ведения реестра, устанавливаемого Министерством строительства и жилищно-коммунального хозяйства Российской Федерации, оператор не позднее срока, указанного в пункте 18 настоящих Правил, уведомляет лицо, сформировавшее проект раздела (части раздела) реестра, о необходимости его доработки и повторной регистрации в государственной информационной системе «Единый государственный реестр заключений экспертизы проектной документации объектов капитального строительства».
20. Внесение изменений в сведения и документы, включенные в реестр, осуществляется оператором в соответствии с порядком ведения реестра, устанавливаемым Министерством строительства и жилищно-коммунального хозяйства Российской Федерации.
21. Лицо, указанное в подпункте «а» пункта 16 настоящих Правил, обеспечивает достоверность, полноту и актуальность сведений и документов, включаемых в проект раздела реестра, и их соответствие требованиям настоящих Правил и порядка ведения реестра, устанавливаемого Министерством строительства и жилищно-коммунального хозяйства Российской Федерации.
22. В случае отрицательного заключения экспертизы в реестр не подлежат включению сведения, указанные в подпунктах «б» — «г» пункта 11 настоящих Правил.
IV. Перечень сведений, доступ к которым обеспечивается всем заинтересованным лицам на бесплатной основе
23. К сведениям реестра, доступ к которым обеспечивается всем заинтересованным лицам на бесплатной основе в информационно-телекоммуникационной сети «Интернет» в форме открытых данных, относятся:
а) номер заключения экспертизы;
б) дата заключения экспертизы;
в) результат проведенной экспертизы (положительное или отрицательное заключение экспертизы);
г) форма экспертизы (государственная, негосударственная);
д) сведения об объекте экспертизы (проектная документация и результаты инженерных изысканий);
е) наименование и адрес (местоположение) объекта капитального строительства, применительно к которому подготовлена проектная документация;
ж) сведения об экспертной организации;
з) сведения о застройщике (техническом заказчике), обеспечившем подготовку проектной документации;
и) сведения об индивидуальных предпринимателях и (или) юридических лицах, подготовивших проектную документацию;
к) сведения об использовании при подготовке проектной документации проектной документации повторного использования, в том числе экономически эффективной проектной документации повторного использования (дата и номер заключения экспертизы, выданного в отношении использованной проектной документации);
л) сведения о признании проектной документации экономически эффективной проектной документацией повторного использования в соответствии с решением Министерства строительства и жилищно-коммунального хозяйства Российской Федерации (дата и номер решения, сведения о лице, которому принадлежит исключительное право на проектную документацию либо право на ее многократное использование, в том числе для подготовки на ее основе проектной документации).
Правительство Российской Федерации постановляет:
1. Утвердить прилагаемые изменения, которые вносятся в постановление Правительства Российской Федерации от 31 марта 2011 г. № 237 «О порядке обеспечения вещевым довольствием должностных лиц таможенных органов Российской Федерации и признании утратившими силу некоторых актов Правительства Российской Федерации» (Собрание законодательства Российской Федерации, 2011, № 15, ст. 2119; 2013, № 42, ст. 5363; 2016, № 2, ст. 406; 2019, № 25, ст. 3269).
2. Федеральной таможенной службе обеспечить сотрудников таможенных органов Российской Федерации погонами нового образца и звездами, соответствующими присвоенному специальному званию, а также предметами форменной одежды нового образца (брюки с кантами зеленого цвета в комплекте с кителем повседневным и курткой повседневной, брюки летние с кантами зеленого цвета) по истечении сроков носки ранее выданных предметов форменной одежды прежних образцов.
3. Установить, что финансовое обеспечение расходных обязательств, связанных с реализацией настоящего постановления, осуществляется в пределах бюджетных ассигнований федерального бюджета, предусмотренных Федеральной таможенной службе на обеспечение вещевым довольствием.
Председатель Правительства Российской Федерации
М.Мишустин
| Издавший орган | Тип документа | Номер документа | Дата документа |
| Правительство РФ | Постановление | 1231 | 15.08.2020 |
< Ранее