Краткий очерк истории химии
ГЕЙ-ЛЮССАК (Gay-Lussac), Жозеф Луи
6 декабря 1778 г. – 9 мая 1850 г.
 Французский физик и химик Жозеф Луи Гей-Люссак родился в Сен-Леонар-де-Нобла (департамент Верхняя Вьенна). Получив в детстве строгое католическое воспитание, в 15 лет он переехал в Париж; там, в пансионе Сансье, юноша продемонстрировал незаурядные математические способности. В 1797-1800 гг. Гей-Люссак учился в Политехнической школе в Париже, где химию преподавал Клод Луи Бертолле. После окончания школы Гей-Люссак был ассистентом Бертолле. В 1809 г. он почти одновременно стал профессором химии в Политехнической школе и профессором физики в Сорбонне, а с 1832 г. – ещё и профессором химии Парижского ботанического сада.
Французский физик и химик Жозеф Луи Гей-Люссак родился в Сен-Леонар-де-Нобла (департамент Верхняя Вьенна). Получив в детстве строгое католическое воспитание, в 15 лет он переехал в Париж; там, в пансионе Сансье, юноша продемонстрировал незаурядные математические способности. В 1797-1800 гг. Гей-Люссак учился в Политехнической школе в Париже, где химию преподавал Клод Луи Бертолле. После окончания школы Гей-Люссак был ассистентом Бертолле. В 1809 г. он почти одновременно стал профессором химии в Политехнической школе и профессором физики в Сорбонне, а с 1832 г. – ещё и профессором химии Парижского ботанического сада.
Научные работы Гей-Люссака относятся к самым разным областям химии. В 1802 г. независимо от Джона Дальтона Гей-Люссак открыл один из газовых законов – закон теплового расширения газов, позже названный его именем. В 1804 г. он совершил два полёта на воздушном шаре (поднявшись на высоту 4 и 7 км), во время которых выполнил ряд научных исследований, в частности измерил температуру и влажность воздуха. В 1805 г. совместно с немецким естествоиспытателем Александром фон Гумбольдтом установил состав воды, показав, что соотношение водорода и кислорода в её молекуле равно 2:1. В 1808 г. Гей-Люссак открыл закон объёмных отношений, который представил на заседании Философско-математического общества: «При взаимодействии газов их объёмы и объёмы газообразных продуктов соотносятся как простые числа». В 1809 г. он провел серию опытов с хлором, подтвердивших вывод Гэмпфри Дэви, что хлор – это элемент, а не кислородсодержащее соединение, а в 1810 г. установил элементарный характер калия и натрия, затем фосфора и серы. В 1811 г. Гей-Люссак совместно в французским химиком-аналитиком Луи Жаком Тенаром значительно усовершенствовал метод элементного анализа органических веществ.
В 1811 г. Гей-Люссак начал обстоятельное исследование синильной кислоты, установил её состав и провёл аналогию между нею, галогеноводородными кислотами и сероводородом. Полученные результаты привели его к концепции водородных кислот, опровергающей чисто кислородную теорию Антуана Лорана Лавуазье. В 1811-1813 гг. Гей-Люссак установил аналогию между хлором и иодом, получил иодистоводородную и иодную кислоты, монохлорид иода. В 1815 г. он получил и изучил «циан» (точнее говоря, дициан), что послужило одной из предпосылок формирования теории сложных радикалов.
Гей-Люссак работал во многих государственных комиссиях и составлял по поручению правительства доклады с рекомендациями по внедрению научных достижений в промышленность. Прикладное значение имели и многие его исследования. Так, его метод определения содержания этилового спирта был положен в основу практических способов определения крепости алкогольных напитков. Гей-Люссак разработал в 1828 г. методику титриметрического определения кислот и щелочей, а 1830 г. – объёмный способ определения серебра в сплавах, применяющийся и в настоящее время. Созданная им конструкция башни для улавливания оксидов азота в дальнейшем нашла применение в производстве серной кислоты. В 1825 г. Гей-Люссак совместно с Мишелем Эженом Шеврёлем получили патент на производство стеариновых свечей.
В 1806 г. Гей-Люссак был избран членом Французской академии наук и её президентом в 1822 и 1834 гг.; состоял членом Аркёйского научного общества (Societe d’Archueil), основанного Бертолле. В 1839 г. он получил титул пэра Франции.
М.В. Ломоносов — первый Российский академик-химик
По материалам книги Б.Н. Меншуткина «Жизнеописание Михаила Васильевича Ломоносова»
| Предыдущая часть | Следующая часть |
Закон сохранения веса вещества при химическом взаимодействии. Огонь, горение и обжигание металлов. Опыты Р. Бойля, М. В. Ломоносова и А. Лавуазье
В настоящее время в основание всех химических превращений мы кладем закон сохранения веса вещества, который заключается в том, что общий вес химических веществ, вступающих во взаимодействие, равен весу образующихся при этом новых веществ. Мысль о том, что вещество, вообще, не может исчезать или твориться, что количество его во вселенной остается постоянным, высказана давно и принималась философами XVII, XVIII вв. как самоочевидное положение, не требующее каких-либо доказательств. У химиков этого времени мы встречаем иногда это положение, напр. в одном из сочинений Роберта Бойля. Но никто до Ломоносова не считал его важнейшим законом, который лежит в основании всего здания химии, — очевидно, вследствие неприменения в химических исследованиях количественного метода, на которое мы уже указывали, за отсутствием данных химических опытов, аналогичных тем, которые делал известный Б. фан Гельмонт около 1640 г. Так, например, он брал отвешенное количество серебра, растворял его в азотной кислоте, переводя его в азотносеребряную соль; прокаливанием азотносеребряной соли добывал из нее обратно серебро и вес так полученного серебра в точности равнялся весу первоначально взятого серебра.
Мысли об этом положении находим еще в ранних заметках Ломоносова, вероятно заимствованные из какого-нибудь сочинения; с полной же ясностью он высказал их впервые в письме к известному математику Л. Эйлеру, 5 июля 1748 г., в тех же самых выражениях, в каких он потом (1758) сообщил их Конференции Академии в диссертации об отношении количества вещества и веса и в «Рассуждении о твердости и жидкости тел» (1760): «Все перемены в Натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет. Сей всеобщей естественной закон простирается и в самые правила движения: ибо тело, движущее своею силою другое, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает».
Очевидно, Ломоносов не торопился с опубликованием этого закона, вероятно потому, что считал его, с одной стороны, общеизвестным в виду указанного выше давно высказанного философами положения; с другой, — потому, что в течение долгого времени не имел сам ясного представления о значении его при химических превращениях. В 1753-1756 гг. он произвел как раз ряд опытов, о которых я сейчас скажу и которые должны были убедить его в справедливости закона и в приложимости его к химическим процессам. Обыкновенно считается, что впервые этот закон высказал А. Лавуазье в 1789 г., в своем курсе химии; но последний нигде определенно не называет его законом. Любопытно, что в учебниках и руководствах химии закон сохранения веса вещества при химических реакциях стал помещаться лишь с 1860-х годов, после того, как он получил возможно тщательную проверку на опыте в работах Ж. Стаса. В нынешнем столетии в опытах Г. Ландольта такая проверка была снова сделана: закон сохранения веса оказывается вполне точным в пределах точности взвешиваний. Этот закон тесно связан с одним из вопросов, особенно привлекавших к себе внимание химиков XVII и XVIII столетий и составлявших предмет работ чуть ли не каждого из них. Это — вопрос о природе огня, о процессах горения и обжигания металлов. Эти процессы естественно являлись в то время основными в химии, так как почти единственным действующим агентом при химических операциях был огонь в том или ином виде. Огонь, как уже указано, считался в то время еще почти всеми за особый химический элемент, который, правда, не могли выделить, что не мешало, однако, признавать его элементом. В свою очередь, из тех химических превращений, которые происходят при помощи огня, очень большое внимание привлекали к себе явления обжигания неблагородных металлов, именно этим и отличавшихся от металлов благородных, не поддающихся действию огня. Такое действие огня просто показать, если взять кусок неблагородного металла, напр, свинца или олова, и нагревать его на воздухе. Металл сперва плавится, потом мало-помалу переходит в серое вещество, не имеющее по наружному виду ничего общего с металлом: получается по прежнему обозначению «окалина» металла, по теперешнему- «окисел». Если взвесить до обжигания кусок металла и затем образовавшуюся из него окалину, то оказывается, что последняя весит значительно больше, чем металл. Как объяснить этот факт, подмеченный еще в XII в.? Не упоминая о тех предположениях, которые строились для этого раньше, скажем, что к середине XVIII столетия явления обжигания металлов объясняли, главным образом, двумя гипотезами: по одной — огненная материя проходит через стенки сосуда, где находится обжигаемый металл, и соединяется с металлом; по другой — каждый металл состоит из окалины металла и флогистона, при обжигании флогистон улетает и остается окалина. Первая гипотеза считалась прочно установленной опытами известного английского химика Роберта Бойля; вторая защищалась Е. Шталем и его последователями, к числу которых в то время принадлежали почти все химики.
Ломоносов, как мы уже знаем, весьма скептически относился к невесомым веществам своего века и отрицал их существование. Точно также он не верил в огненную материю и подверг ее в своих размышлениях о причине теплоты и холода такой беспощадной критике, что члены Конференции, по прослушании диссертации, вернули ее Ломоносову для смягчения выражений, употребленных им по адресу Р. Бойля. В этой же диссертации Ломоносов говорит о возможности другого объяснения увеличения веса металла при обжигании — а именно, от соединения металла с воздухом, все время окружающим обжигаемый металл. Эта же мысль высказана им и в письме к Л. Эйлеру (5 июля 1748 г.).
Но против такого предположения говорило одно обстоятельство. Как упомянуто, Р. Бойль подтвердил свою гипотезу опытом, заключавшимся в следующем (1673). Р. Бойль взял кусок свинца, поместил его в стеклянную реторту (сосуд с длинной, направленной вниз, шейкою), герметически ее заплавил и взвесил. Затем он нагрел ее в таком виде на огне, и свинец перешел в окалину; после этого он вскрыл реторту (причем Р. Бойль отметил вхождение в нее воздуха со свистом, как признак герметического запаивания реторты) и снова взвесил: оказался привес, для объяснения которого он и предложил свою гипотезу о способности огненной материи проходить через стекло реторты и затем соединяться с металлом.
Ломоносов повторил этот опыт в 1756 г.; сам он пишет об этом следующее: «Делал опыты в заплавленных накрепко стеклянных сосудах, чтобы исследовать, прибывает ли вес металлов от чистого жару. Оными опытами нашлось, что славного Роберта Бойла мнение ложно, ибо без пропущения внешнего воздуха вес сожженного металла остается в одной мере». Ломоносов констатировал, так же как Р. Бойль, что при вскрытии такой реторты после опыта в нее входит воздух. Тем самым было доказано: а) что привес металла при обжигании обусловлен соединением его с воздухом; б) что объяснение процесса обжигания металла при помощи флогистона невозможно: если бы флогистон уходил из металла, то заплавленная реторта с металлом должна была бы иметь иной вес после нагревания. Все эти опыты были сообщены Ломоносовым Конференции Академии, но не опубликованы, а потому остались совершенно неизвестными.
17 лет спустя, в 1773 г., опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов. Но он сделал новое, очень важное, наблюдение, а именно, что только часть воздуха запаянной реторты соединилась с металлом и что увеличение веса металла, перешедшего в окалину, равно уменьшению веса воздуха в реторте. Вместе с тем часть металла осталась в свободном виде. Отсюда Лавуазье сделал вывод, что воздух состоит из двух газов, из которых один соединяется с металлом, другой — нет. Этот вывод был проверен на опыте обжиганием ртути в реторте, сообщавшейся с определенным объемом воздуха под стеклянным колоколом, погруженным в ртуть. Через 12 дней обжигание было прекращено, потому что объем воздуха под колоколом перестал уменьшаться; оставшийся в колоколе воздух не поддерживал горения, мышь в нем не могла жить, а потому Лавуазье назвал его азотом — что по-гречески значит негодный для жизни. Получившаяся красная окалина ртути при сильном прокаливании распалась на ртуть и тот газ, который был поглощен ртутью из воздуха: в этом газе свеча горела с ослепительным блеском, мышь чувствовала себя превосходно; это был кислород. Таким образом, были окончательно разъяснены процессы обжигания металлов и вместе с тем доказано, что воздух — не элемент, но содержит около 4/5 азота, 1/5 кислорода. А затем Лавуазье же доказал, что горение есть, вообще, соединение горящего или обжигаемого вещества с кислородом воздуха.
Из этого очевидно, как близко подошел Ломоносов к величайшим открытиям XVIII в., положившим начало новой химии, не признававшей вещества флогистона.
| Предыдущая часть |
Закон постоянства состава
Закон сохранения массы вещества
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Ломоносов создал при Академии наук химическую лабораторию. В ней он изучал протекание химических реакций, взвешивая исходные вещества и продукты реакции. При этом он установил закон сохранения массы веществ.
Читается закон таким образом: масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции. Ломоносов впервые сформулировал этот закон в 1748 г, а экспериментально подтвердил его на примере сжигания металлов в запаянных сосудах в 1756 г. Несколько позднее (1789 г.) – закон сохранения массы был независимо от Ломоносова установлен французским химиком Лавуазье, который показал, что при химических реакциях сохраняется не только общая масса вещества, но и масса каждого из элементов, входящих в состав взаимодействующих веществ.
В результате установления закона в химии прочно утвердились количественные методы исследования. Был изучен количественный состав многих веществ. При этом был установлен закон постоянства состава.
Читается закон постоянства состава так: каждое химическое соединение имеет постоянный состав независимо от способа его получения, т.е. всегда состоит из одних и тех же элементов, соединенных друг с другом в строго определенном отношении. Так, например, каким бы путем ни получали воду, в ее состав всегда входит водород и кислород в постоянном весовом отношении 1:8.
а) 2Н2 + О2 = 2Н2О б) НCl + NaOH = NaCl + H2O
Многие элементы, соединяясь друг с другом, могут образовать разные вещества, каждое из которых характеризуется определенным соотношением между массами этих элементов. Так, углерод образует с кислородом два соединения. Один из них – оксид углерода (II), содержит 42,88% (масс.) углерода и 57,12% (масс.) кислорода.
Второе соединение – диоксид углерода (IV) – содержит 27.29% (масс.) углерода и 72,71% (масс.) кислорода. Изучая подобные соединения Дальтон (английский ученый), в 1803г. установил закон кратных отношений. Читается этот закон так: если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящихся в этих соединениях на одну и ту же массу другого, относится между собой как небольшие целые числа.
|
СО СО2 16:32=1:2 16 32
|
Итак: на одну единицу массы углерода в диоксиде углерода приходится ровно в 2 раза больше кислорода, чем в оксиде углерода (II).
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Измеряя объемы газов, вступающих в реакцию, и образующихся в результате реакции Гей-Люссак пришел к обобщению, известному под названием закона простых объемных отношений.
Читается закон так: объемы вступающих реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа.
В 1811 г. итальянский физик Авогадро объяснил простые отношения между объемами газов, наблюдающиеся при химических реакциях, установил закон:
В равных объемах любых газов, взятых при одной и той же температуре, и при одинаковом давлении, содержится одно и то же число молекул.
С точки зрения этой гипотезы, хорошо объяснялись экспериментальные факты. Так, два объема хлористого водорода из одного объема хлора и одного объема водорода могут получиться только в том случае, если молекулы водорода и хлора «раскалываются» пополам, давая начало двум новым молекулам, следовательно, молекулы водорода и хлора должны состоять из нескольких атомов, число их должно быть четным и минимальное – 2
Н2 + Cl2 = 2НCl
В моле любого вещества число молекул равно 6,02·1023. Оно носит название числа Авогадро и обозначается буквой N. Из законов объемных отношений Гей-Люссака и Авогадро вытекают важные следствия.
1. Объем 1 моля любого газа при нормальных условиях занимает объем 22,4 л. Пользуясь этой величиной, можно вычислить массу заданного объема газа. При этом должны быть известны температура и давление заданного объема или массы газа. Вычисления могут быть сделаны как с помощью обычных пропорций, так и на основе уравнения Клапейрона-Менделеева:
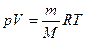 ,
,
где  – давление, объем, заданная масса, молекулярная масса; M и Т – абсолютная температура газа; R –универсальная газовая постоянная. Итак:
– давление, объем, заданная масса, молекулярная масса; M и Т – абсолютная температура газа; R –универсальная газовая постоянная. Итак:
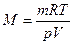 .
.
Литература:
1. Диккерсон Р., Грей Г., Хейт Дж. Основные законы химии.- М: Мир, 1982.- Т.1.
В течение тысячелетий люди верили, что вещество может бесследно исчезать, а также возникать из ничего. Это утверждение подтвердил и такой известный учёный, как Роберт Бойль.
Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз масса окалины оказывалась больше массы прокаливаемого металла.
Вот что записал учёный после одного из своих опытов в 1673 году:
«После двух часов нагревания был открыт запаянный кончик реторты, причём в неё ворвался с шумом наружный воздух. По нашему наблюдению при этой операции была прибыль в весе на 8 гранов…»

Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748 года он написал в письме Леонарду Эйлеру:
«Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет…»
Лишь в 1756 году Ломоносову удалось проверить опытным путём теоретически открытый закон сохранения массы вещества при химических реакциях. Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая.
«Оными опытами нашлось, что славного Роберта Бойля мнение ложно, ибо без пропущения внешнего воздуха вес сожжённого металла остаётся в одной мере…»
Спустя 41 год после опытов Ломоносова французский учёный Антуан Лоран Лавуазье практически повторил формулировку закона в своём учебнике.
Современная формулировка закона сохранения массы:
Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения закон объясняется тем, что общее количество атомов в результате не изменятся, а происходит лишь их перегруппировка.
Закон сохранения массы веществ применяют при составлении уравнений химических реакций. Что такое уравнение реакции и как его составить?
Таким образом, уравнение химической реакции – это условная запись химической реакции с помощью химических формул и коэффициентов.
Вещества, которые изначально вступили в реакцию, называются исходными веществами.
вещества, образующиеся в результате реакции, называются продуктами реакции.
Тренинг: (выполняя задания, дождитесь, когда картинка меняться не будет)
Исходные вещества и продукты реакции
Химические уравнения
Расстановка коэффициентов в уравнениях реакций
Домашнее задание: параграф 28, с. 166-167 вопросы 1, 2, 4
Французский химик, один из создателей современной химии.
Не зная о идеях М.В. Ломоносова, заново открыл закон сохранения массы. Обнаружил, что воздух имеет сложный состав; определил состав воды; объяснил сущность горения и окисления, разработал принципы химической номенклатуры.
«Именно Лавуазье правильно соединяя вместе все части головоломки и создал условия, при которых развитие химической теории стало происходить в правильном направлении. Прежде всего Лавуазье объявил, что теория, в основе которой лежит флогистон, совершенно неверна; вообще не существует такой субстанции, как флогистон. Процесс горения происходит в результате химического взаимодействия горючих веществ с кислородом. Во-вторых, вода вовсе не является простым веществом, а представляет собой сочетание кислорода и водорода. Воздух также не является простой субстанцией, он представляет собой сочетание, главным образом, двух газов — водорода и азота. Все эти утверждения представляются сегодня вполне очевидными. Однако они вовсе не казались очевидными предшественникам Лавуазье и его современникам. Даже когда Лавуазье сформулировал свою теорию и представил её доказательства, многие ведущие химики отказались принять его соображения. Однако превосходный учебник Лавуазье «Начальный учебник химии» (1789) так чётко изложил его гипотезы и настолько убедительно представил доказательства в их пользу, что молодое поколение химиков быстро в них уверилось. Доказав, что вода и воздух не являются химическими элементами, Лавуазье включил в свою книгу список веществ, которые он считал элементарными. Несмотря на то, что в его книге было несколько ошибок, современный список химических элементов является расширенной версией таблицы Лавуазье.
Лавуазье уже разработал (в содружестве с Бертолле, Фуркруа и Гитоном де Морво) первую систему химической номенклатуры. В системе Лавуазье (которая составляет основу современной системы) входящие в неё химические вещества систематизировались по их названию. Принятие первой единообразной системы номенклатуры позволило химикам во всем мире лучше информировать друг друга о произведенных ими открытиях.
Лавуазье чётко изложил принцип сохранения массы в химических реакциях: химическая реакция может перестроить элементы, представленные в первоначальных веществах, но независимо от того, какова была степень разрушения, конечные продукты весят столько же, сколько и первоначальные компоненты. Настойчивость, с которой Лавуазье подчеркивал важность взвешивания химикатов, участвующих в реакции, способствовала превращению химии в точную науку и проторила дорогу для многих других достижений, обеспечивших дальнейший прогресс химической науки.
Лавуазье сделал некоторый вклад в развитие геологии, а в области физиологии его вклад был значительным. Путем тщательных экспериментов (работая в содружестве с Лапласом) он сумел доказать, что физиологический процесс дыхания эквивалентен медленному горению. Иными словами, человеческие существа и животные получают энергию в результате медленного внутреннего горения органического материала; они дышат, получая кислород из воздуха. Одно только это открытие, Которое, очевидно, можно сравнить по значению с открытием Гарвеем циркуляции крови, позволяет Лавуазье с успехом занять место в нашем списке. И всё же главная заслуга Лавуазье состоит в том, что он заложил основы химической теории и тем самым направил развитие химической науки на правильный путь. Его принято называть «отцом современной химии», и он по праву заслужил этот титул».
Майкл Харт, 100 великих людей, М., «Вече», 1998 г., с. 122-124.
«В своей классической книге «Начальный курс химии» (1789 г.) Лавуазье неоднократно ссылается на труды французского философа Кондильяка, который развил идеи английского философа-материалиста эмпирика Локка и способствовал их распространению во Франции. Кондильяк считал единственным источником мышления ощущение, а основой научной работы — опыт. В соответствии с этим Лавуазье всегда шёл в своих исследованиях от неизвестного к известному и не делал выводов, не подкреплённых опытом и наблюдениями».
Биографии великих химиков / Под ред. Карла Хайнинга, М., «Мир», 1981 г., с.73.
«В годы Первой республики прославленный химик служил комиссаром финансовой палаты (общественной казны) и, обвинённый в заговоре и должностных преступлениях, по суду революционного трибунала в числе других 28-ми откупщиков был гильотинирован 8 марта 1794 г. Сохранялась некоторая надежда, что Лавуазье спасут его учёная европейская слава, множество друзей и почитателей, но террор сковал всех. В начальные годы первой империи в среде французской науки и литературы предложение раболепия превышало спрос на него. Сохранилось предание, что Лавуазье просил отсрочить казнь и предоставить ему время довести до конца задуманное исследование.
Палачу, говорил впоследствии знаменитый французский математик Лагранж (1736-1813), стоило только одного мгновения отрубить такую голову, но целого века было недостаточно, чтобы снова произвести подобную. В столетнюю годовщину Французской революции (1889) в Париже было решено открыть памятник Лавуазье, поскольку именно в 1789 г. он предложил «Таблицу простых тел», по существу первую классификацию элементов. В том же году совместно с К.Л. Бертолле (1748-1822) и другими учёными основал журнал «Annales de Chimie».
В 1789 г. появилась его книга «Трактат о химии», означавшая не менее глубокую революцию научной мысли, зарождение классической химии.
Памятник Лавуазье открыли через 10 лет, в 1899 году».
Помпеев Ю.А., Очерки по истории европейской научной мысли, СПб, «Абрис», 2003 г., с. 225.