Содержание
- «О ввозе в Российскую Федерацию и вывозе из нее лекарственных средств и фармацевтических субстанций»
- Постановление Правительства РФ 5.12.1998 N 1539 (ред. от 27.11.2006) «О ввозе в Российскую Федерацию и вывозе из нее лекарственных средств и фармацевтических субстанций»
- Положение о ввозе в Российскую Федерацию и вывозе из нее лекарственных средств и фармацевтических субстанций
- Химики: опасный госсипол в «Кагоцеле» есть, но вреда он не принесёт. Как и пользы
- Иммуномодуляторы «лечат» только сахарами
- Чем лечиться?
- Правовые основы
- Порядок импорта лекарственных средств и фармацевтических субстанций
- Разрешение Минздрава на ввоз лекарственных средств
- Сертификация медицинских препаратов
- Наши услуги
- Наши преимущества
Постановление Правительства РФ от 25.12.1998 N 1539
«О ввозе в Российскую Федерацию и вывозе из нее лекарственных средств и фармацевтических субстанций»
(ред. от 27.11.2006)
Постановление Правительства РФ 5.12.1998 N 1539 (ред. от 27.11.2006) «О ввозе в Российскую Федерацию и вывозе из нее лекарственных средств и фармацевтических субстанций»
Во исполнение Федеральных законов «О государственном регулировании внешнеторговой деятельности» и «О лекарственных средствах» Правительство Российской Федерации постановляет:
1. Утвердить прилагаемое Положение о ввозе в Российскую Федерацию и вывозе из нее лекарственных средств и фармацевтических субстанций.
2. Признать утратившими силу Постановления Правительства Российской Федерации от 27 мая 1997 г. N 647 «О ввозе и вывозе лекарственных средств и фармацевтических субстанций» (Собрание законодательства Российской Федерации, 1997, N 22, ст. 2606) и от 19 декабря 1997 г. N 1606 «О внесении дополнения в пункт 2 Положения о ввозе и вывозе лекарственных средств и фармацевтических субстанций, утвержденного Постановлением Правительства Российской Федерации от 27 мая 1997 г. N 647» (Собрание законодательства Российской Федерации, 1998, N 1, ст. 124).
3. Настоящее Постановление вступает в силу через 60 дней после его опубликования.
Российской Федерации
Е.ПРИМАКОВ
Постановлением Правительства
Российской Федерации
от 25 декабря 1998 г. N 1539
Положение о ввозе в Российскую Федерацию и вывозе из нее лекарственных средств и фармацевтических субстанций
Данный документ утратил силу в части установления порядка ввоза и вывоза лекарственных средств, предназначенных для медицинского применения, в связи с изданием Постановления Правительства РФ от 16.07.2005 N 438, вступившего в силу с 20 сентября 2005 года.
С 20 сентября 2005 года данный документ утратил силу в части установления порядка ввоза и вывоза лекарственных средств, предназначенных для медицинского применения в связи с вступлением в силу Постановления Правительства Российской Федерации от 16.07.2005 N 438, и действует только в части установления порядка ввоза по лицензиям в Российскую Федерацию лекарственных средств, применяемых в ветеринарии (по перечню согласно Приложению N 2) , и вывоза из Российской Федерации лекарственных средств, применяемых в ветеринарии. См. письмо ФТС РФ от 13.09.2005 N 01-06/31709.
1. Настоящее Положение определяет порядок ввоза по лицензиям в Российскую Федерацию лекарственных средств и фармацевтических субстанций (далее именуются — лекарственные средства) по перечням согласно приложениям N 1 и 2, а также вывоза из Российской Федерации лекарственных средств.
2. Ввозить лекарственные средства на территорию Российской Федерации могут следующие юридические лица:
- предприятия-производители лекарственных средств (для целей собственного производства лекарственных средств);
- предприятия, осуществляющие оптовую торговлю лекарственными средствами;
- научно-исследовательские учреждения, институты, лаборатории (для разработки, проведения исследования и контроля качества, эффективности, безопасности лекарственных средств);
- иностранные предприятия-производители лекарственных средств и предприятия, осуществляющие оптовую торговлю лекарственными средствами, при условии, что они имеют собственные представительства на территории Российской Федерации.
3. Вывозить лекарственные средства с территории Российской Федерации могут следующие юридические лица:
- предприятия-производители лекарственных средств;
- предприятия, осуществляющие оптовую торговлю лекарственными средствами.
Физические лица могут вывозить лекарственные средства в количествах, необходимых для личного использования.
Примечание.
В соответствии с Постановлением Правительства РФ от 27.08.2004 N 443 выдачу лицензий и других разрешительных документов на осуществление экспортно-импортных операций с отдельными видами товаров осуществляет Министерство экономического развития и торговли российской Федерации.
4. Ввоз в Российскую Федерацию лекарственных средств, указанных в приложениях N 1 и 2 к настоящему Положению, осуществляется на основании лицензии на ввоз лекарственных средств, выдаваемой Министерством торговли Российской Федерации, а также на основании сертификата предприятия-производителя лекарственных средств, удостоверяющего, что ввозимые лекарственные средства произведены в соответствии с государственными стандартами качества лекарственных средств, установленными нормативными актами Российской Федерации (далее именуется — сертификат качества). Ввозимые лекарственные средства должны быть зарегистрированы в Российской Федерации в установленном порядке.
5. Разрешается ввоз в Российскую Федерацию лекарственных средств (в том числе незарегистрированных) без лицензии на ввоз лекарственных средств или разрешения Министерства здравоохранения Российской Федерации или Министерства сельского хозяйства и продовольствия Российской Федерации, если они предназначены для:
- личного использования физическими лицами, прибывающими на территорию Российской Федерации;
- работников дипломатического корпуса или представителей международных организаций, аккредитованных в Российской Федерации;
- лечения пассажиров транспортных средств, прибывающих на территорию Российской Федерации;
- лечения животных в зоопарках при наличии соответствующего обращения ветеринарной службы Министерства сельского хозяйства и продовольствия Российской Федерации.
При наличии разрешения Министерства здравоохранения Российской Федерации или Министерства сельского хозяйства и продовольствия Российской Федерации допускается ввоз конкретной партии:
- лекарственных средств (в том числе незарегистрированных) для проведения клинических исследований, регистрации, перерегистрации;
- лекарственных средств (в том числе незарегистрированных) для разработки, проведения исследования и контроля качества, эффективности, безопасности лекарственных средств научно-исследовательскими учреждениями, институтами, лабораториями;
- зарегистрированных лекарственных средств, предназначенных для гуманитарных целей.
6. Утратил силу. — Постановление Правительства РФ от 23.05.2002 N 338.
7. Лицензия на ввоз лекарственных средств выдается в соответствии с Положением о порядке лицензирования экспорта и импорта товаров (работ, услуг) в Российской Федерации после согласования с Министерством здравоохранения Российской Федерации (в части лекарственных средств, применяемых в медицинских целях) либо с Министерством сельского хозяйства и продовольствия Российской Федерации (в части лекарственных средств, применяемых в ветеринарии).
8. Соискатель лицензии на ввоз лекарственных средств представляет в Министерство здравоохранения Российской Федерации или в Министерство сельского хозяйства и продовольствия Российской Федерации заявление установленного Министерством торговли Российской Федерации образца, предварительно согласованное с Постоянным комитетом по контролю наркотиков при Министерстве здравоохранения Российской Федерации (в графе «Особые условия»), и заверенные подписью и печатью соискателя лицензии копии следующих документов:
а) лицензия на один из видов деятельности, связанной с обращением лекарственных средств (фармацевтическая деятельность, производство лекарственных средств, хранение лекарственных средств, распространение лекарственных средств);
б) контракт (договор);br в) договор между экспортером (или импортером) и производителем или потребителем товара, если в качестве соискателя лицензии выступает посредник;
г) учредительные и регистрационные документы (устав, свидетельство о государственной регистрации, справка о постановке на учет в налоговом органе);
д) сведения о государственной регистрации каждого из лекарственных средств с указанием соответствующих регистрационных номеров (в случае ввоза);
е) данные о юридическом лице, перемещающем лекарственные средства.
Принадлежность лекарственных средств к продукции, применяемой в ветеринарных целях, подтверждается наличием технических условий (ГОСТа) для препаратов отечественного производства или регистрационного удостоверения Департамента ветеринарии Министерства сельского хозяйства и продовольствия Российской Федерации и наставления по применению для импортных препаратов.
9. При согласовании заявления на получение лицензии на ввоз лекарственных средств Министерство здравоохранения Российской Федерации или Министерство сельского хозяйства и продовольствия Российской Федерации заполняет графу «Согласовано» бланка заявления.
10. Федеральные органы исполнительной власти, указанные в пункте 7 настоящего Положения, могут отказать в согласовании заявления на получение лицензии на ввоз лекарственных средств из-за отсутствия регистрационных удостоверений на указанные в заявлении лекарственные средства, сообщения недостоверных данных о сделке или об условиях контрактов, наносящих ущерб экономическим интересам Российской Федерации. В случае отказа в согласовании заявления о соответствующем мотивированном решении сообщается соискателю лицензии в письменной форме.
11. Министерство здравоохранения Российской Федерации или Министерство сельского хозяйства и продовольствия Российской Федерации в течение 15 рабочих дней с даты представления документов на согласование сообщает соискателю лицензии на ввоз лекарственных средств о согласовании заявления на лицензию или об отказе в согласовании.
12. Представление таможенным органам Российской Федерации лицензии на ввоз лекарственных средств или ее копии, разрешения Министерства здравоохранения Российской Федерации, Министерства сельского хозяйства и продовольствия Российской Федерации или их копий, сертификата качества или его копии осуществляется в порядке, определяемом Государственным таможенным комитетом Российской Федерации.
13. Вывоз из Российской Федерации лекарственных средств, указанных в приложениях N 1 и 2 к настоящему Положению, осуществляется по лицензии на внешнеторговую деятельность с лекарственными средствами при наличии сведений об отсутствии в составе вывозимых лекарственных средств наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, указанных в перечне, утвержденном Постановлением Правительства Российской Федерации от 30 июня 1998 г. N 681 (Собрание законодательства Российской Федерации, 1998, N 27, ст. 3198), ядовитых и сильнодействующих веществ и веществ, включенных в таблицы I и II Конвенции ООН о борьбе против незаконного оборота наркотических средств и психотропных веществ 1988 года, номенклатура которых утверждена Постановлением Правительства Российской Федерации от 3 августа 1996 г. N 930 (Собрание законодательства Российской Федерации, 1996, N 34, ст. 4122). Указанные сведения представляются в порядке, определяемом Министерством здравоохранения Российской Федерации, Министерством сельского хозяйства и продовольствия Российской Федерации и Государственным таможенным комитетом Российской Федерации.
14. Соискатель лицензии на ввоз лекарственных средств в случае нарушения настоящего Положения несет ответственность в соответствии с законодательством Российской Федерации.
Приложение №1
к Положению
о ввозе в Российскую Федерацию
и вывозе из нее лекарственных
средств и фармацевтических
субстанций
Примечание.
Правила ввоза и вывоза лекарственных средств, зарегистрированных в Российской Федерации, а также перечень лекарственных средств и фармацевтических субстанций, применяемых в медицинских целях, ввоз которых в Российскую Федерацию осуществляется по лицензиям, установлены Постановлением Правительства РФ от 16.07.2007 N 438.
ПЕРЕЧЕНЬ ЛЕКАРСТВЕННЫХ СРЕДСТВ И ФАРМАЦЕВТИЧЕСКИХ СУБСТАНЦИЙ, ПРИМЕНЯЕМЫХ В МЕДИЦИНСКИХ ЦЕЛЯХ, ВВОЗ КОТОРЫХ В РОССИЙСКУЮ ФЕДЕРАЦИЮ ОСУЩЕСТВЛЯЕТСЯ ПО ЛИЦЕНЗИЯМ (в ред. Постановлений Правительства РФ от 22.02.2000 N 148, от 30.11.2001 N 830) ————————————————-T—————¬ ¦ ¦ Код ¦ ¦ ¦ ТН ВЭД России ¦ L————————————————+—————- Органические химические соединения, используемые из 2904 — 2909 в качестве фармацевтических субстанций из 2912 — 2942 00 000 0 (в ред. Постановления Правительства РФ от 30.11.2001 N 830) Железы и прочие органы, предназначенные для из 3001 органотерапии, высушенные, измельченные или не измельченные в порошок; экстракты желез или прочих органов или их секретов, предназначенные для органотерапии; гепарин и его соли; прочие вещества человеческого или животного происхождения, предназначенные для терапевтических или профилактических целей, в другом месте не поименованные Кровь человеческая; кровь животных, из 3002 приготовленная для использования в терапевтических, профилактических или диагностических целях; сыворотки иммунные (антисыворотки) и фракции крови, прочие и модифицированные иммунологические продукты, в том числе полученные биотехнологическим путем; вакцины, токсины, культуры микроорганизмов (кроме дрожжей) и аналогичные продукты, используемые в медицинских целях Лекарственные средства (кроме из 3003 лекарственных средств товарных позиций 3002, 3005 или 3006), состоящие из смеси двух или более продуктов, для использования в терапевтических или профилактических целях, но не расфасованные в виде дозированных лекарственных форм или в упаковки для розничной продажи (кроме используемых для ветеринарии) Лекарственные средства (кроме из 3004 лекарственных средств товарных позиций 3002, 3005 и 3006), состоящие из смешанных или несмешанных продуктов, для использования в терапевтических или профилактических целях, расфасованные в виде дозированных лекарственных форм или в упаковки для розничной продажи (кроме используемых в ветеринарии) Препараты контрастные для рентгенографических 3006 30 000 0 обследований ; реагенты диагностические, предназначенные для введения больным (в ред. Постановления Правительства РФ от 22.02.2000 N 148) Средства химические контрацептивные, 3006 60 изготовленные на основе гормонов или спермицидов
Приложение №2
к Положению
о ввозе в Российскую Федерацию
и вывозе из нее лекарственных
средств и фармацевтических
субстанций
ПЕРЕЧЕНЬ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРИМЕНЯЕМЫХ В ВЕТЕРИНАРИИ, ВВОЗ КОТОРЫХ В РОССИЙСКУЮ ФЕДЕРАЦИЮ ОСУЩЕСТВЛЯЕТСЯ ПО ЛИЦЕНЗИЯМ (в ред. Постановлений Правительства РФ от 22.02.2000 N 148, от 30.11.2001 N 830, от 27.11.2006 N 718) ————————————————T—————-¬ ¦ ¦ Код ¦ ¦ ¦ ТН ВЭД России ¦ L————————————————+—————— Аминокислоты из 2922 41 000 0 из 2922 49 из 2930 40 из 2930 90 130 0 из 2930 90 160 0 (в ред. Постановлений Правительства РФ от 22.02.2000 N 148, от 30.11.2001 N 830, от 27.11.2006 N 718) Кумарины (зоокумарины) из 2932 21 000 0 (в ред. Постановления Правительства РФ от 22.02.2000 N 148) Провитамины и витамины для животных из 2936 Гормоны для сельскохозяйственных животных из 2937 Гликозиды и алкалоиды для ветеринарии из 2938 из 2939 Антибиотики ветеринарные из 2941 Готовые к использованию в лечебных и из 3001 20 900 0, профилактических целях формы ветеринарных из 3001 90 980 0 препаратов из тканей и органов животных (в ред. Постановлений Правительства РФ от 22.02.2000 N 148, от 27.11.2006 N 718) Сыворотки иммунные из крови животных из 3002 10 100 1, из 3002 10 100 9 (в ред. Постановления Правительства РФ от 22.02.2000 N 148) Фракции крови прочие для ветеринарии из 3002 10 910 0 из 3002 10 990 0 (в ред. Постановления Правительства РФ от 22.02.2000 N 148) Вакцины ветеринарные 3002 30 000 0 (в ред. Постановления Правительства РФ от 22.02.2000 N 148) Кровь животных, приготовленная для из 3002 90 300 0 профилактических, терапевтических или диагностических целей (в ред. Постановления Правительства РФ от 22.02.2000 N 148) Культуры микроорганизмов (вакцинные и прочие из 3002 90 500 0 штаммы) (в ред. Постановления Правительства РФ от 22.02.2000 N 148) Прочие биопрепараты ветеринарные: из 3002 наборы и препараты для диагностики и типизации возбудителей болезней, изготовленные на основе крови животных и культур микроорганизмов Лекарственные средства для ветеринарии из 3003 из 3004 Реагенты для определения группы крови животных из 3006 20 000 0 (в ред. Постановления Правительства РФ от 22.02.2000 N 148) Реагенты сложные диагностические или из 3822 00 000 0 лабораторные для ветеринарии (в ред. Постановления Правительства РФ от 22.02.2000 N 148) Инсектициды, фунгициды, средства из 3808 91, дезинфицирующие для ветеринарии из 3808 92, из 3808 94 (в ред. Постановления Правительства РФ от 27.11.2006 N 718) Отравленная приманка в виде съедобного продукта из 3808 99 (в ред. Постановления Правительства РФ от 27.11.2006 N 718) Мыла для ветеринарии; вещества поверхностно- из 3401 активные органические и средства, применяемые в ветеринарии в качестве мыла, содержащие медикаментозные (лекарственные) добавки Вещества поверхностно-активные органические из 3402 (кроме мыла) для ветеринарии; поверхностно- активные средства, моющие средства для ветеринарии
Противовирусный препарат «Кагоцел» уже давно вызывает дискуссии в обществе и во врачебных кругах. С одной стороны, его активно продвигают на официальном уровне, как минимум Минздрава, с другой — многие врачи указывают на то, что эффективность и безопасность препарата мало изучены ввиду отсутствия клинических испытаний, отвечающих современным требованиям. Так, доктор медицинских наук Павел Воробьёв ещё в 2015 году указывал:
Те исследования, которые проводились, малочисленны и недостаточны для качественной оценки эффективности, а значит, его эффект не доказан с научной точки зрения, равно как до сих пор не доказана его безопасность.
Кроме того, активное действующее вещество «Кагоцела» является производным от госсипола, о чём сообщается, в том числе, на официальном сайте препарата. Госсипол — вещество, получаемое из хлопчатника. Оно обладает не только противовирусными и противоопухолевыми свойствами, как указано на сайте «Кагоцела», но также подавляет сперматогенез и испытывался в Китае в качестве контрацептива. В ходе испытаний было выявлено, что госсипол токсичен, а при длительном приёме может привести к бесплодию.
Этот факт и порождает основные страхи.
В конце января этого года депутат Сергей Шаргунов направил запрос в Минздрав, где сообщил об опасениях граждан в связи с препаратом. Минздрав заверил, что все испытания «Кагоцел» прошёл своевременно, бесплодием он не грозит, госсипола в нём нет, а жалоб не поступало.
Однако учёные в безопасность и эффективность спорного препарата не верят. Поэтому Комиссия РАН по борьбе с лженаукой обратилась в Российский химико-технологический университет им. Менделеева, чтобы всё-таки разобраться в том, есть ли повод беспокоиться насчёт «Кагоцела».
Химики: опасный госсипол в «Кагоцеле» есть, но вреда он не принесёт. Как и пользы
Ответ от химико-технологического университета был следующим. В составе «Кагоцела» госсипол действительно есть, но он связан ковалентными связями с карбоксиметилцеллюлозой, а потому не может проявлять присущую ему биологическую активность. По словам химиков, эта активность — противовирусная и противомалярийная, а среди побочных эффектов действительно — подавление сперматогенеза и гепатотоксичность (токсичность для печени).
Но в таком случае, если госсипол в «Кагоцеле» не может проявлять активность, значит, и его противовирусные свойства должны исчезнуть. То есть препарат в лучшем случае бесполезен. К слову, карбоксиметилцеллюлоза, которая «гасит» вредные свойства госсипола, сама по себе никакой пользы здоровью тоже не приносит. Она используется в промышленности как загуститель, влагоудерживающий агент, связующее вещество, применяется в производстве косметических и чистящих средств, краски, клея.
Но может ли сложное вещество, являющееся активным компонентом «Кагоцела», разложиться в организме человека на составляющие, то есть на госсипол и карбоксиметилцеллюлозу? Да, говорят учёные, однако процесс разложения идёт слишком медленно, поэтому «его концентрации в организме человека при соответствующем инструкции пероральном применении не могут достигать опасных для здоровья значений».
 Скриншот страницы официального сайта kagocel.ru
Скриншот страницы официального сайта kagocel.ru
И всё же у Комиссии РАН по лженауке остались вопросы по «Кагоцелу».
«Судя по всему, это полимер, значит, он имеет свойство накапливаться в организме. Кто изучал этот процесс и как, ещё предстоит выяснить», — цитирует портал «Доктор Питер» советника председателя комиссии Сергея Финаева.
Так что вопрос о безопасности «Кагоцела» остаётся открытым. Однако учёные-химики уже, по сути, подтвердили его бесполезность.
Но «Кагоцел» — не единственная загадка современной российской фармакологии.
Иммуномодуляторы «лечат» только сахарами
Академик РАН Алексей Хохлов в феврале этого года решил проверить несколько препаратов, которые заявлены как эффективные лекарства от гриппа и ОРВИ, физико-химическим путём. Он закупил в аптеках «Анаферон», «Артрофоон», «Эргоферон», «Оциллококцинум» и «Субетту» и отдал их в лабораторию МГУ на масс-спектрометрический анализ, который выявляет концентрацию различных элементов, входящих в состав вещества.
Оказалось, что во всех исследуемых препаратах не содержится ничего, кроме сахаров. То есть действующее вещество, которое бы боролось с болезнью, в них напрочь отсутствует — с точностью до фемтограммов (〖10〗^(-15) г).
После публикации результатов анализа в Facebook Алексей Хохлов, по его словам, получил много откликов в соцсетях и СМИ, а также от компаний-производителей исследованных им препаратов. Производители настаивали, что действующее вещество в их лекарствах всё же есть, но «его концентрация намного меньше предела чувствительности метода масс-спектрометрии». Однако Хохлов указывает, что даже яды, разведённые до такой концентрации, не нанесут никакого вреда организму, что уж говорить о лекарственных препаратах.
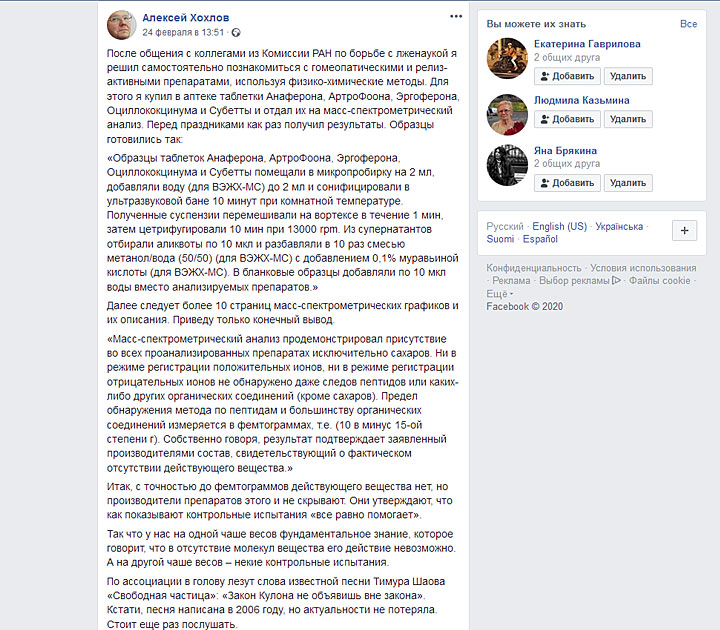 Фото: Алексей Хохлов / facebook.com
Фото: Алексей Хохлов / facebook.com
Он посоветовал перепроверить контрольные испытания данных препаратов, задействовав независимых экспертов, а не ссылаться на то, что «всё равно помогает».
Чем лечиться?
По мнению кандидата медицинских наук, врача-терапевта Алексея Хухрева, препаратов, которые лечат от вирусных инфекций, в современной России практически нет. Он упомянул «Арбидол», который сейчас называют эффективным противовирусным средством: этот препарат оказывает некое защитное действие, но «ещё не известны все за и против его рутинного применения».
Сам Хухрев назвал Царьграду только два эффективных средства, которые продаются в России:
Есть только несколько доказанных препаратов, которые работают конкретно против вируса гриппа. Сюда относятся «Тамифлю» (осельтамивир) и «Реленза» (занамивир). Они на грипп работают, это доказано. Из всех остальных противовирусных препаратов, продающихся в аптеках, ни один не обладает доказанным на больших группах населения положительным эффектом против вирусов. Все респираторные вирусы проходят сами.
Журнал «Ремедиум» №7-8, 2019г.
DOI: http://dx.doi.org/10.21518/1561-5936-2019-7-8-33-36
Надежда Калинина, «Ремедиум»
Важнейшей статьей импорта в Россию является поставка лекарственных препаратов (ЛП), фармацевтической продукции и медицинского оборудования. Напомним, что по итогам 2018 года общий объем фармацевтического рынка ЛП составил 1,3 трлн руб. за 5,2 млрд упаковок в ценах конечного потребления, что на 3,0% больше в стоимостном и на 3,3% ниже в натуральном выражениях показателей предыдущего года. Порядка 70% ЛП на всем российском фармрынке составляли импортные лекарственные средства . В данной публикации мы рассмотрим ключевые показатели активности производителей и стран-поставщиков по импорту субстанций ЛП на территории России.
Import of pharmaceutical substances at year-end 2018
Nadezhda Kalinina, Remedium
Важнейшей статьей импорта в Россию является поставка лекарственных препаратов (ЛП), фармацевтической продукции и медицинского оборудования. Напомним, что по итогам 2018 года общий объем фармацевтического рынка ЛП составил 1,3 трлн руб. за 5,2 млрд упаковок в ценах конечного потребления, что на 3,0% больше в стоимостном и на 3,3% ниже в натуральном выражениях показателей предыдущего года. Порядка 70% ЛП на всем российском фармрынке составляли импортные лекарственные средства . В данной публикации мы рассмотрим ключевые показатели активности производителей и стран-поставщиков по импорту субстанций ЛП на территории России.
Импорт лекарственных средств и фармацевтических субстанций в настоящее время является одним из основных факторов развития российского фармацевтического рынка, так как обеспечивает поступление на рынок инновационных разработок в сфере фармацевтики, а также является одним из источников поступлений денежных средств в бюджеты различных уровней (за счет налоговых и таможенных сборов).
По итогам 2018 года в Россию было ввезено субстанций на сумму 1,36 млрд долл., что меньше на 9% аналогичного периода прошлого года. Натуральные темпы роста также находятся в заметном минусе -4%. На протяжении всего 2018 года в нашу страну было импортировано 13,38 млн кг субстанций (рис. 1).
Рисунок 1. Динамика объема импорта субстанций ЛП в стоимостном и натуральном выражениях в 2014–2018 гг.

Источник: Клифар «Импорт-Экспорт»
Наиболее важной причиной снижения объемов импорта в стоимостном показателе является девальвация рубля по отношению к ведущим валютам.
Родина здоровья
Что касается географической структуры импорта субстанций ЛП в 2018 г., то здесь отмечаем незначительные изменения по сравнению с 2017 г.
В разрезе стран происхождения субстанций наибольшая доля импортируемого товара традиционно была произведена в Китае (табл. 1). В натуральном выражении, несмотря на снижение темпов поставок, данный показатель аккумулирует львиную долю закупок (порядка 59,8%). Китайские производители сегодня поставляют широкий диапазон субстанций в различных ценовых категориях. Количество субстанций, предлагаемых Поднебесной, сегодня достигает порядка 120 наименований. К тому же субстанции из Китая примерно в 53 раза дешевле европейских: средняя стоимость 1 кг вещества, произведенного в Китае, – около 27 долл., в Европе – около 1452 долл. Стоит отметить, что китайские субстанции используют не только российские производители. В Поднебесной размещены собственные производства многих крупных западных корпораций, потому что там дешевле и разрешено размещение экологически грязных предприятий. Однако в последние годы доля закупки китайских субстанций заметно снижается. Благодаря программе по импортозамещению в России выросли продажи и производства собственных субстанций.
Рейтинг топ-5 стран-производителей сформировали также Франция, Словения, Германия и Индия. Следует отметить значительное увеличение объемов поставок субстанций из Германии, в денежном выражении их прирост составил +118%.
Таблица 1. Топ-5 стран происхождения субстанций в стоимостном и натуральном выражениях в 2018 г. и их приросты (2018 г. к 2017 г.)
Источник: Клифар «Импорт-Экспорт»
В разрезе стран-поставщиков импорт субстанций в 2018 г. был осуществлен из 59 стран. В общем объеме импорта субстанций ЛС в России в денежном и натуральном выражении несколько изменился их удельный вес. По итогам 2018 г. объем поставок субстанций от поставщиков из Китая в денежном выражении увеличился на 11% (рис. 2), из Бельгии — на 32%, из Германии — на 85%. А для поставщиков из Словении и Франции зафиксировано уменьшение этого показателя по сравнению с предыдущим годом (-59% и -4% соответственно). В целом же суммарная доля представленного рейтинга топ-5 стран — поставщиков субстанций ЛС уменьшилась до 61% в общем объеме импорта субстанций в денежном выражении.
Рисунок 2. Долевое соотношение топ-5 стран – крупнейших поставщиков субстанций ЛС в общем объеме импорта в стоимостном выражении в 2016–2018 гг.

Источник: Клифар «Импорт-Экспорт»
Курс на импортозамещение
Как уже упоминалось ранее, российский фармацевтический рынок по-прежнему импортоориентирован. Порядка 70% препаратов, представленных на всем отечественном фармацевтическом рынке, остаются преимущественно импортными, по показателю объемов продаж лекарственных средств – 30% препаратов российского происхождения. Именно поэтому первые места в рейтинге топ-5 поставщиков-получателей занимают иностранные компании (табл. 2). Вместе с этим за девять лет с момента принятия стратегии развития фармацевтической промышленности (Фарма-2020) сделано достаточно много, огромное число площадок уже локализовано в Российской Федерации. Отечественные компании продолжают держать курс на разработку и производство собственных субстанций. Так, российские фармацевтические компании «НоваМедика» и «Фармсинтез» приступили к реализации совместного проекта, благодаря которому российские пациенты в течение 1,5–2 лет получат доступ к ряду эффективных препаратов, полный цикл производства которых будет локализован в России. Эти лекарственные средства относятся к терапевтическим областям — анестезиологии и гастроэнтерологии — и предназначены как для госпитального, так и для коммерческого рынков . Фармацевтическая компания «Герофарм» запустила в Санкт-Петербурге новую производственную площадку по выпуску инсулина, которая профинансирована без иностранных соинвесторов. После выхода на проектную мощность завод сможет производить 1000 кг субстанции в год, что позволит обеспечить 100%-ную потребность населения России в препаратах инсулина, а также развивать экспортное направление. Уникальность этого проекта заключается в полной независимости технологического процесса производства от поставок импортного сырья . К 2021 г. российская компания «Биокад» планирует создать высокотехнологичное фармацевтическое производство на площадке «Алабушево» в ОЭЗ «Технополис Москва». После запуска завод в течение семи лет будет поставлять для столицы 22 препарата, минимум двум из которых обеспечат производство полного цикла, включая выпуск биологической субстанции. Это позволит локализовать производства лучших современных онкопрепаратов на территории Москвы и повысить обеспеченность пациентов новыми препаратами .
По итогам 2018 г. крупнейшим импортером субстанций ЛС как в денежном, так и в натуральном выражении стала компания Servier (табл. 2), объем поставок продукции которой в России составил порядка 190 млн долл. за 191 тыс. кг. Причем в денежном выражении темп прироста импортера увеличился по сравнению с 2017 г. незначительно (+2%), в натуральном же и вовсе снизился (-4%). Одной из важных закупок корпорации остается субстанция гесперидин + диосмин для производства оригинального венотонизирующего и венопротекторного препарата Детралекс.
Вторым крупнейшим по объему получения субстанций стала компания КРКА-РУС. По итогам 2018 года компания импортировала такого вида продукцию на сумму 177 млн долл. за 205 тыс. кг.
Третью строчку рейтинга занимает компания Gedeon Richter, продемонстрировавшая высокие темпы роста импортируемых субстанций как в денежном (+72%), так и в натуральном (92%) показателях.
Для компании Sanofi, занимающей четвертую позицию в разрезе представленного рейтинга, был зафиксирован максимальный прирост объемов поставок субстанций как в стоимостном выражении (+232%), так и в натуральном (+362%), что говорит о значительном увеличении объемов импорта и закупки более дорогостоящего сырья, чем в 2017 г. Германия по-прежнему остается основной страной-поставщиком для закупки инсулина – ключевой субстанции Sanofi. Аналогичная ситуация характерна также для компании Pfizer, замыкающей рейтинг. Показатели прироста объемов поставок субстанций ЛС в натуральном и стоимостном выражении составили +17% и +83% соответственно. В целом же удельный вес топ-5 крупнейших поставщиков – получателей субстанций в 2018 г. составил 43,9% поставок в денежном и 3,4% в натуральном выражении. По данным Клифар «Импорт-Экспорт», за минувший 2018 г. количество импортеров, поставляющих фармакопейные субстанции в Россию, увечилось с 625 до 775.
Таблица 2. Топ-5 крупнейших поставщиков — получателей субстанций в стоимостном и натуральном выражениях в 2018 г. и их приросты (2018 г. к 2017 г.)
Источник: Клифар «Импорт-Экспорт»
В общем объеме импорта субстанций ЛС в 2018 г. доля представленных топ-10 субстанций в денежном выражении увеличилась по сравнению с 2017 г. и составила 29,8%. Рейтинг субстанций возглавил инсулин, поставки которого существенно увеличились и составили порядка 94,3 млн долл. (прирост продаж +446%) (табл. 3). Отметим производство готовой лекарственной формы препарата Газива для терапии пациентов с диагнозами «хронический лимфолейкоз» и «фолликулярная лимфома» (обинутузумаб) на мощностях завода «Уфавита АО» (Фармстандарт) в Республике Башкортостан. Первые серии препарата были выпущены в конце 2018 г., объем поставки субстанции составил порядка 27,4 млн долл.
Также увеличились поставки субстанции с МНН ралтегравир, которые осуществляет производитель MSD для локализации препарата Исентресс на площадке Ярославского завода готовых лекарственных форм группы компаний «Р-Фарм» . Процесс производства включает подготовку активного фармацевтического ингредиента и вспомогательных веществ, приготовление готовой лекарственной формы, упаковку и выпускающий контроль качества. Совместный проект MSD и «Р-Фарм» по локализации производства ралтегравира был инициирован еще в 2015 г. За все это время производственные мощности «Р-Фарм» позволяют полностью обеспечить потребности российского здравоохранения в ралтегравире, включенного в список ЖНВЛП.
Таблица 3. Топ-10 субстанций ЛС по объему импорта в стоимостном показателе в 2018 г.
Источник: Клифар «Импорт-Экспорт»
Доля импорта тоннажного объема субстанций ЛС также увеличилась и составила 51,9% (табл. 4). До сих пор популярен импорт субстанций таких широко известных препаратов, как парацетамол, ацетилсалициловая кислота, аскорбиновая кислота и др., пользующиеся высоким спросом у населения в основном за счет их низкой стоимости.
Таблица 4. Топ-10 субстанций ЛС по объему импорта в натуральном показателе в 2018 г.
| Рейтинг | Субстанция | Топ-1 поставщик-получатель | Объемы поставок, млн кг | Прирост поставок 2018/2017 гг., %, кг |
| 1 | Парацетамол | «Фармстандарт» | 1,68 | -10% |
| 2 | Ацетилсалициловая кислота | «Фармстандарт» | 1,54 | 2% |
| 3 | Метформин | «Фармстандарт» | 1,49 | 30% |
| 4 | Аскорбиновая кислота | «Фармстандарт» | 0,7 | 69% |
| 5 | Кальция карбонат | Takeda | 0,48 | -2% |
| 6 | Метамизол натрия | ЦВ «Протек» | 0,37 | -27% |
| 7 | Омепразол | «ПроМед» | 0,33 | -23% |
| 8 | Ибупрофен | «Фармстандарт» | 0,2 | 39% |
| 9 | Альфа-токоферола ацетат | ДСМ Нутришнл Продактс РУС | 0,16 | 238% |
| 10 | Гесперидин + Диосмин | Servier | 0,14 | -12% |
Источник: Клифар «Импорт-Экспорт»
Безусловно, сложившаяся структура внешней торговли лекарственных средств и фармацевтических субстанций, свидетельствующая об импортной лекарственной зависимости России, имеет ряд негативных последствий («национальная безопасность», низкий уровень инвестиций в российскую фармацевтическую промышленность и т. д.). К сожалению, на сегодняшний день реалии импорта субстанций в стране таковы, что до создания и появления на рынке достойных российских аналогов или локализации большинства производств ЛП иностранных компаний на территории России пройдет еще порядка десяти лет, в течение которых обойтись без импортных поставок будет просто невозможно. Возрождение производства отечественных фармсубстанций во многом будет связано с капиталообразующими усилиями частно-государственных партнерств, находящихся в особых экономических зонах (например, фармкластеры в России), имеющих ряд налоговых льгот и преференций. А пока, несмотря на продолжающуюся программу по импортозамещению, российский фармацевтический рынок остается наиболее привлекательным для импортеров.
Важнейшей статьей импорта в Россию является лекарственные средства, фармацевтическая продукция и медицинское оборудование. До 75 % лекарственных препаратов на полках аптек в России – это импорт. Практически 99 % медицинского оборудования в России – это импорт продукции западного производства. Оборот фармацевтических препаратов и лекарственных средств в России составляет порядка 600 миллионов долларов США за один календарный месяц, ввоз медицинского оборудования и фармацевтических субстанций имеет преференции и облагается нулевой ввозной пошлиной.
Несмотря на программу по импортозамещению лекарственных средств и медицинских продуктов, данная область останется надолго привязана к внешнему рынку и потому наиболее привлекательной для импортеров.
Правовые основы
Порядок ввоза лекарственных средств на территорию Российской Федерации определяется Постановлением Правительства РФ от 29.09.2010 N 771 «О порядке ввоза лекарственных средств для медицинского применения на территорию Российской Федерации», а также таможенным законодательством Таможенного союза в рамках ЕАЭС и законодательством Российской Федерации о таможенном деле.
Следует отметить, что ввоз лекарственных препаратов для личного применения, гуманитарных грузов, а также наркотических, психотропных и сильнодействующих ядовитых веществ регулируется дополнительными документами.
Порядок импорта лекарственных средств и фармацевтических субстанций
Ввозить на территорию Российской Федерации лекарственные средства в коммерческих целях имеют право юридические лица:
- Российские предприятия-производители лекарственных средств
- Российские предприятия, осуществляющие оптовую торговлю лекарственными средствами
- Российские научно-исследовательские учреждения, институты, лаборатории (для разработки, исследования и контроля качества)
- Иностранные предприятия, при условии регистрации представительства в России
Разрешение Минздрава на ввоз лекарственных средств
Ввозимые в Российскую Федерацию лекарственные средства должны быть включены в государственный реестр лекарственных средств.
Ввоз незарегистрированных препаратов может осуществляется с целью:
- Проведения клинических исследований лекарственных препаратов
- Проведения экспертизы для осуществления государственной регистрации лекарственных препаратов
- Для оказания медицинской помощи по жизненным показаниям конкретного пациента
Для ввоза на территорию Российской Федерации лекарственных средств и фармакологических субстанций, не внесенных в реестр лекарственных средств, необходимо оформить соответствующее разрешение.
Выдача разрешений на ввоз на территорию Российской Федерации лекарственных препаратов и фармакологических субстанций осуществляется в соответствии с Федеральным законом от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» и осуществляется Министерством здравоохранения Российской Федерации.
Необходимые документы
Для получения разрешения Минздрава на ввоз лекарственных средств необходимо подать заявление с указанием следующих данных:
- Наименование лекарственного препарата
- Лекарственная форма
- Доза, концентрации, фасовки
- Наименование организации — производителя лекарственного препарата
- Страну производства лекарственного препарата
Кроме того, в зависимости от цели ввоза медицинских препаратов, необходимо предоставить ряд документов:
- Копии учредительных и регистрационных документов заявителя
- Сертификат качества ввозимых лекарственных препаратов
- Разрешения Минздрава на проведение клинического исследования
- Заключение консилиума врачей о необходимости применения незарегистрированного препарата по жизненным показаниям
- Копии документов подтверждающих надлежащую маркировку для использования лекарств в клинических исследованиях
Срок оформления разрешения Минздрава составляет не более 5 рабочих дней.
Без разрешения Минздрава могут быть ввезены незарегистрированные медицинские препараты:
- В виде гуманитарной помощи
- Для использования в личных целях
- Для использования работниками дипломатического корпуса
- Для лечения участников международных культурных, спортивных мероприятий и участников международных экспедиций
- Для лечения пассажиров и членов экипажей транспортных средств, прибывших в Российскую Федерацию
- Лечения животных в зоопарках, а также животных, ввозимых в Российскую Федерацию
Сертификация медицинских препаратов
В Российскую Федерацию можно ввозить только лекарственные средства, качество которых подтверждено сертификатом производителя.
Наряду с разрешением Минздрава, сертификат производителя лекарственного средства является важнейшим документом, который необходимо предоставить в таможенные органы при ввозе лекарственных средств в РФ.
Ввоз в Россию несертифицированных лекарственных средств, либо несоответствующих указанным в сертификате свойствам запрещен. Такие лекарственные средства признаются фальсификатом или контрафактной продукцией и подлежат аресту и уничтожению за счет импортера. А на самого импортера может быть наложена административная ответственность за нарушение законодательства об обращении лекарственных средств.
Наши услуги
Специалисты нашей компании имеют опыт ввоза лекарственных средств и фармацевтических субстанций в Россию и ее таможенного оформления. Мы предлагаем полный комплект услуг по оформлению необходимой документации, таможенной очистке и доставке. А также помощь при получении необходимых сертификатов и разрешений.
Мы готовы предоставить вам следующие услуги:
- Консультации по вопросам импорта лекарственных средств и фармацевтических субстанций
- Переговоры с поставщиками
- Составление внешнеторговых договоров
- Оформление сертификатов соответствия
- Составление всей необходимой документации
- Оформление разрешения Минздрава
- Таможенное оформление и очистка
- Доставка в любую точку
Наши преимущества
Индивидуальный подход к каждому клиенту, лояльность и ответственность – это основы нашей фирменной философии. Поэтому в нашей работе мы гарантируем:
- Персональный подход к каждому заказу
- Прозрачность всех процедур
- Высокое качество обслуживания
- Быстроту оформления документов
- Оптимизацию Ваших финансовых затрат
- Юридическую безупречность всех процедур
Мы нацелены на построение взаимовыгодных и долгосрочных деловых отношений с нашими клиентами и партнёрами, как в Германии, так и в России.
Мы всегда будем рады оказать вам профессиональную и квалифицированную помощь и предоставим подробную информацию по любому вопросу, связанному с импортом и таможенным оформлением лекарственных средств и фармацевтических субстанций.